急性缺血性卒中是一种由脑血管闭塞而引起的脑组织缺血及缺氧坏死,有可能造成毁灭性和永久性的中枢神经损伤,这一病理过程涉及线粒体氧化磷酸化功能障碍和细胞生物能量应激。低密度脂蛋白受体相关蛋白 (LRP1)是一种多功能的跨膜受体,可调节血脑屏障完整性、神经元稳态、能量代谢等众多细胞过程,但在缺血性卒中过程中的作用仍不明确。
2024年6月,西南医科大学附属医院、四川大学华西医院和中国科学技术大学团队在Cell Metabolism上发表了题为“Astrocytic LRP1 enables mitochondria transfer to neurons and mitigates brain ischemic stroke by suppressing ARF1 lactylation”的研究论文,揭示了星形胶质细胞中的LRP1通过抑制葡萄糖摄取、糖酵解和乳酸生成,导致ADP-核糖基化因子1 (ARF1)的乳酸化水平降低,进而促进了线粒体向受损神经元的转移,并缓解缺血导致的器官损伤。(麦特绘谱提供[U-13C]葡萄糖、[U-13C]L-谷氨酰胺、[U-13C]乙酸代谢流检测服务)
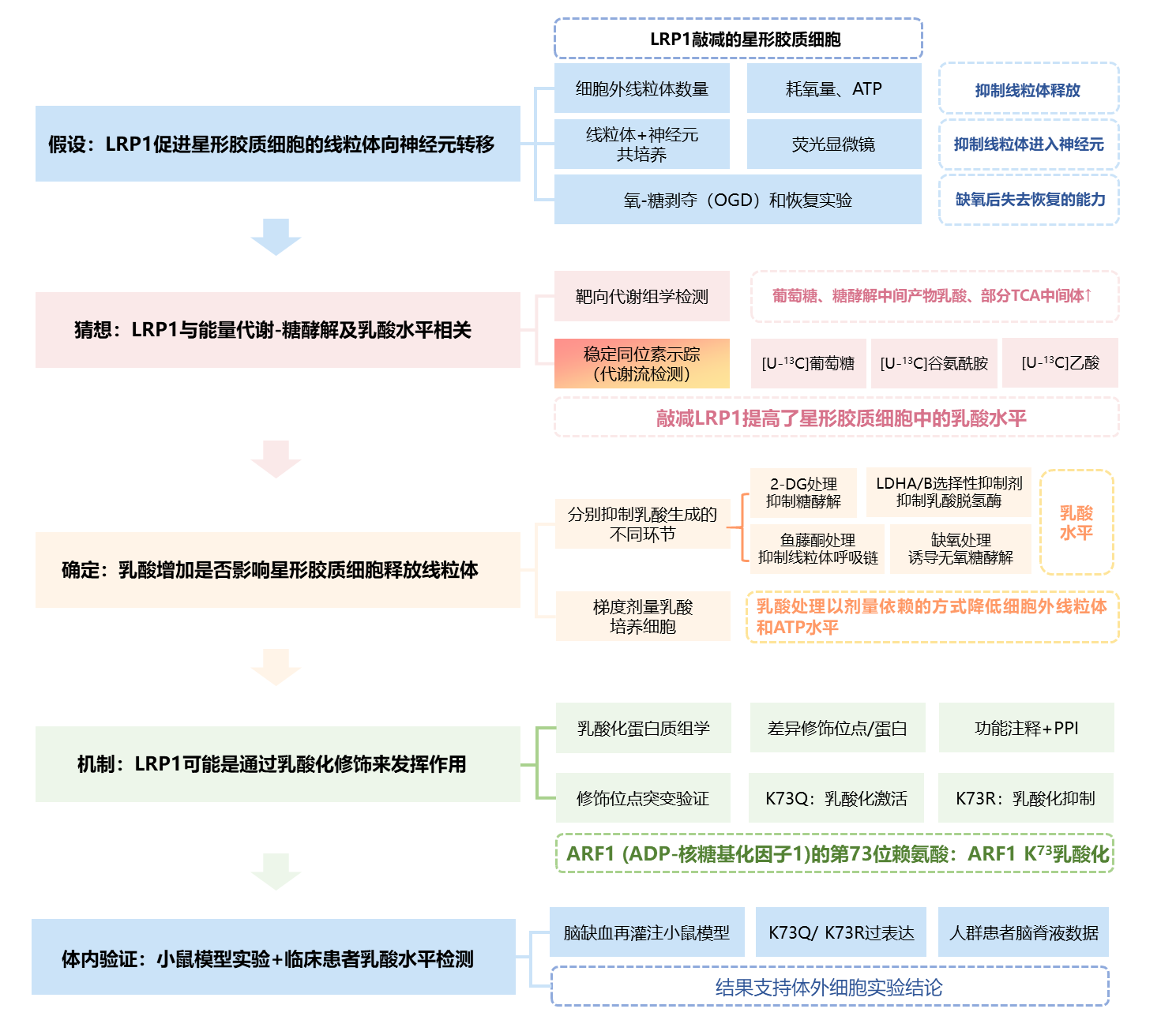
技术路线图
分析结果
1. LRP1缺失会抑制线粒体从星形胶质细胞向神经元转移
已有研究表明,星形胶质细胞可释放健康的线粒体到邻近的神经元,以此来使受损的神经元恢复健康。基于这一假设,研究者利用慢病毒转染设计了LRP1敲减的星形胶质细胞(记为shLrp1)。首先观察到培养基中细胞外线粒体数量降低,且伴随耗氧量和ATP减少,说明敲减LRP1抑制星形胶质细胞释放线粒体;随后分离星形胶质细胞中的线粒体,将之与神经元共培养,荧光显微镜证实,敲减LRP1抑制星形胶质细胞的线粒体向神经元转移;最后进行氧-糖剥夺(OGD)和恢复实验,发现敲减LRP1后的新型胶质细胞失去了恢复神经元活性的能力。
图1. LRP1促进星形胶质细胞的线粒体向神经元转移
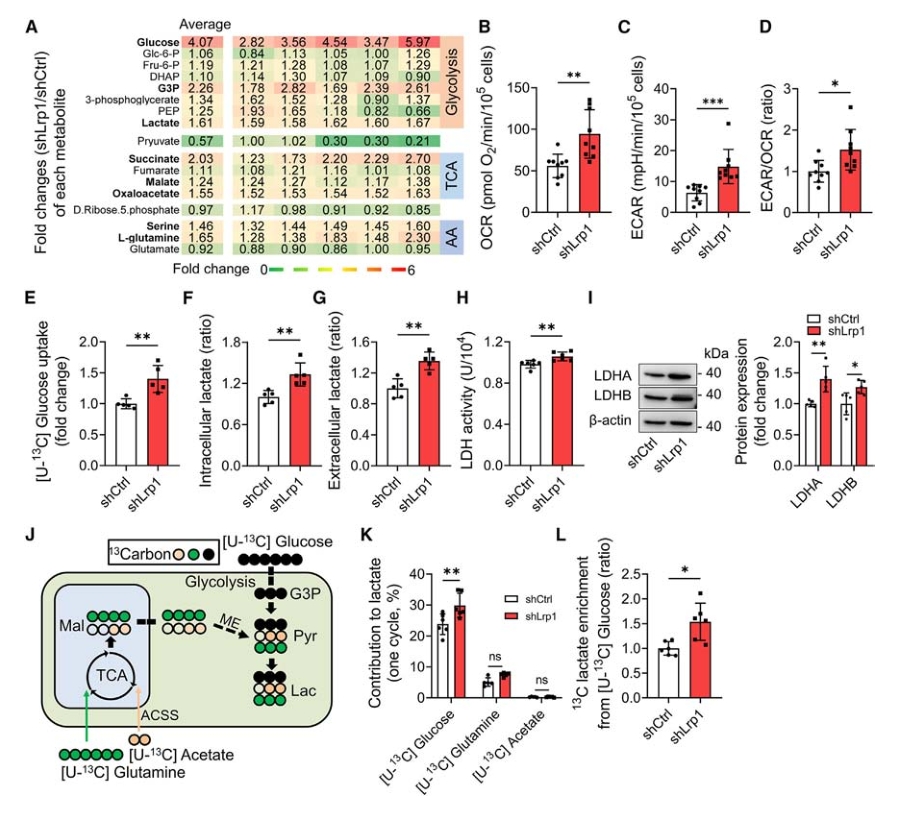
2. LRP1缺失会增加星形胶质细胞的糖酵解及乳酸水平
线粒体在细胞能量代谢中发挥着核心作用,因此研究者推测LRP1介导的线粒体转移可能与能量代谢有关。基于此对shLrp1及对照的星形胶质细胞进行靶向代谢组学分析,发现shLrp1细胞内,葡萄糖、糖酵解中间产物:甘油醛3-磷酸和乳酸,以及部分TCA中间体的水平上升,同时ECAR/OCR比率及ATP生成速率也显著增加。表明敲减LRP1后,星形胶质细胞内糖酵解相对于氧化磷酸化增强。
为进一步确认糖酵解增强是否由葡萄糖摄取的增加引起,研究者使用[U-13C]葡萄糖进行代谢流检测。结果显示,与对照组相比,敲减LRP1显著增加了星形胶质细胞的葡萄糖摄取。随后研究者试图用同样的方法确认增加的乳酸是否来源于糖酵解:使用[U-13C]葡萄糖、[U-13C]L-谷氨酰胺或[U-13C]乙酸分别标记星形胶质细胞,追踪并分析13C进入乳酸及TCA循环代谢物中的情况(代谢流技术由麦特绘谱提供)。结果显示,大多数乳酸由葡萄糖生成,同时敲减LRP1提高了星形胶质细胞中的乳酸水平。
图2. 敲减LRP1可增强星形胶质细胞的糖酵解和乳酸代谢
3.乳酸抑制星形胶质细胞释放功能性线粒体
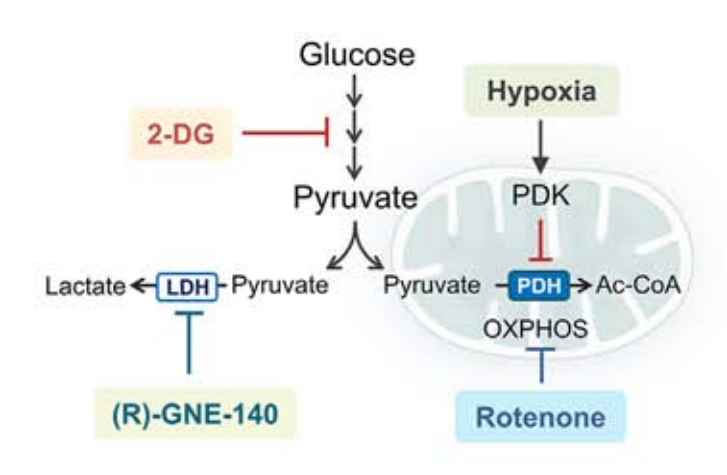
接下来试图确定乳酸的增加是否影响星形胶质细胞的线粒体释放。作者分别抑制了能量代谢过程中可调节乳酸生成的不同环节,随后观察星形胶质细胞细胞内乳酸、细胞外线粒体及ATP等指标的变化。这些抑制实验包括:
● 缺氧处理,诱导无氧糖酵解发生
● 鱼藤酮处理,抑制线粒体呼吸链,即氧化呼吸过程
● 2-DG处理,抑制糖酵解从而抑制乳酸上游的丙酮酸合成
● LDHA/B选择性抑制剂,抑制乳酸脱氢酶活性,干扰乳酸生成
● 敲除Ldha和Ldhb基因,完全阻断乳酸和丙酮酸的相互转换
图3. 调节乳酸产生的各种代谢调节剂
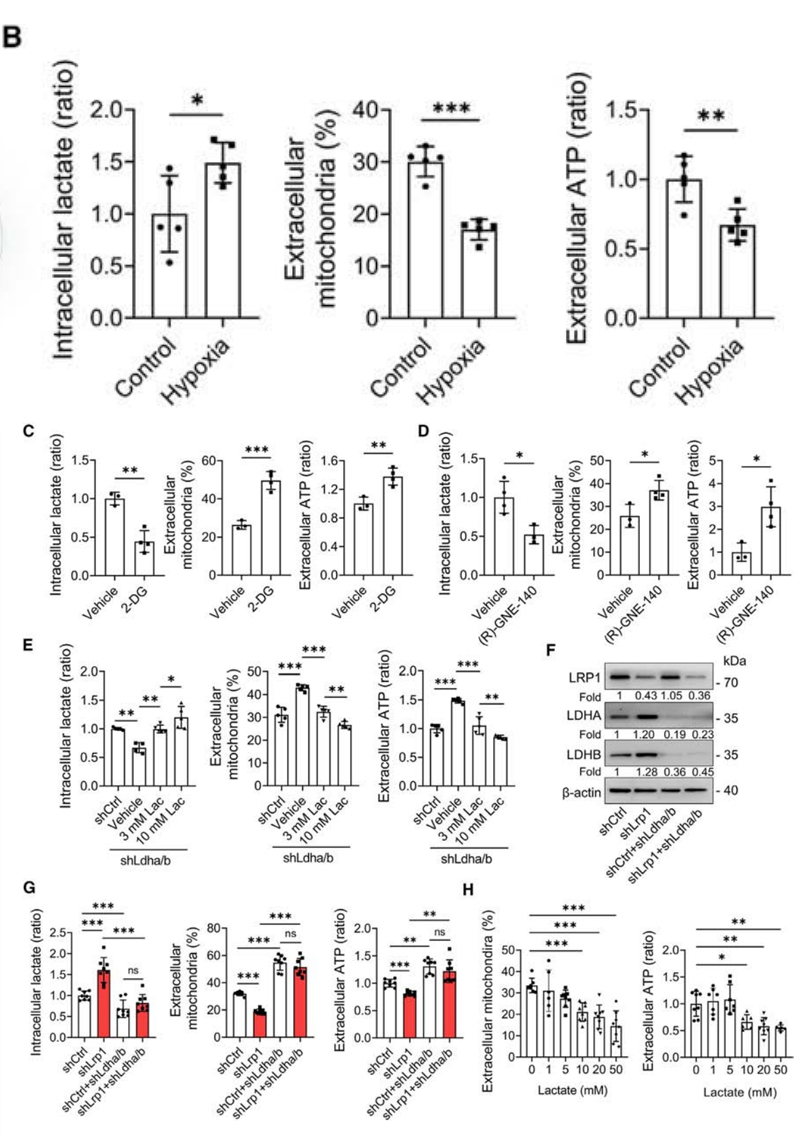
结果表明,抑制丙酮酸合成或者抑制乳酸脱氢酶活性后,均观察到乳酸生成减少,并伴随着细胞外线粒体和ATP水平的增加。进一步地,为了测试乳酸是否调节星形胶质细胞的线粒体释放,使用梯度剂量的乳酸培养细胞,发现乳酸处理以剂量依赖的方式降低细胞外线粒体和ATP水平。
图4. 乳酸抑制星形胶质细胞释放线粒体
综上,这些发现表明LRP1通过抑制星形胶质细胞中的乳酸增加线粒体释放。
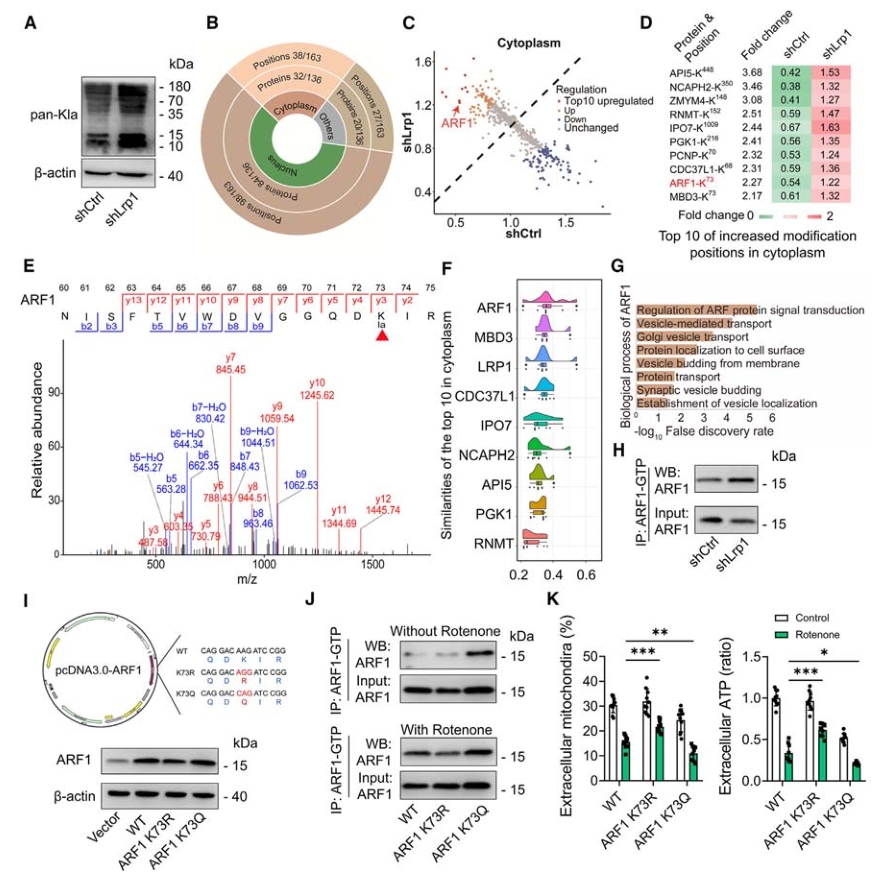
4. ARF1 K73乳酸化介导LRP1诱导的线粒体释放
已知乳酸分子可以与蛋白质中的氨基酸残基发生酯键结合,即发生蛋白的乳酸化修饰,因此研究者假设LRP1可能是通过乳酸化修饰来发挥作用。利用乳酸化蛋白质组学技术对shLrp1和对照星形胶质细胞进行检测,共鉴定到136个差异修饰蛋白和163个差异修饰位点,其中细胞质中乳酸化程度最高的是ARF1 (ADP-核糖基化因子1)的第73位赖氨酸。接下来对该蛋白进行功能分析,从基因本体注释的分子功能和细胞成分方面来看,ARF1与LRP1的功能相似性最高;且蛋白互作网络分析也发现ARF1在线粒体释放中具有潜在的功能。
为进一步验证ARF1-kla73是否是线粒体释放的关键介质,对ARF1的73号位赖氨酸位点进行了突变:突变为谷氨酰胺的K73Q(激活乳酸化)和突变为精氨酸的K73R(抑制乳酸化)。随后观察到K73R突变体的ARF1活性受到抑制,且伴随线粒体释放上调的现象。反之,激活乳酸化修饰的K73Q突变体则会抑制线粒体的释放。
图5. ARF1 K73乳酸化介导的LRP1诱导-线粒体释放
以上结果说明,乳酸通过ARF1-Kla73减少星形胶质细胞的线粒体释放。
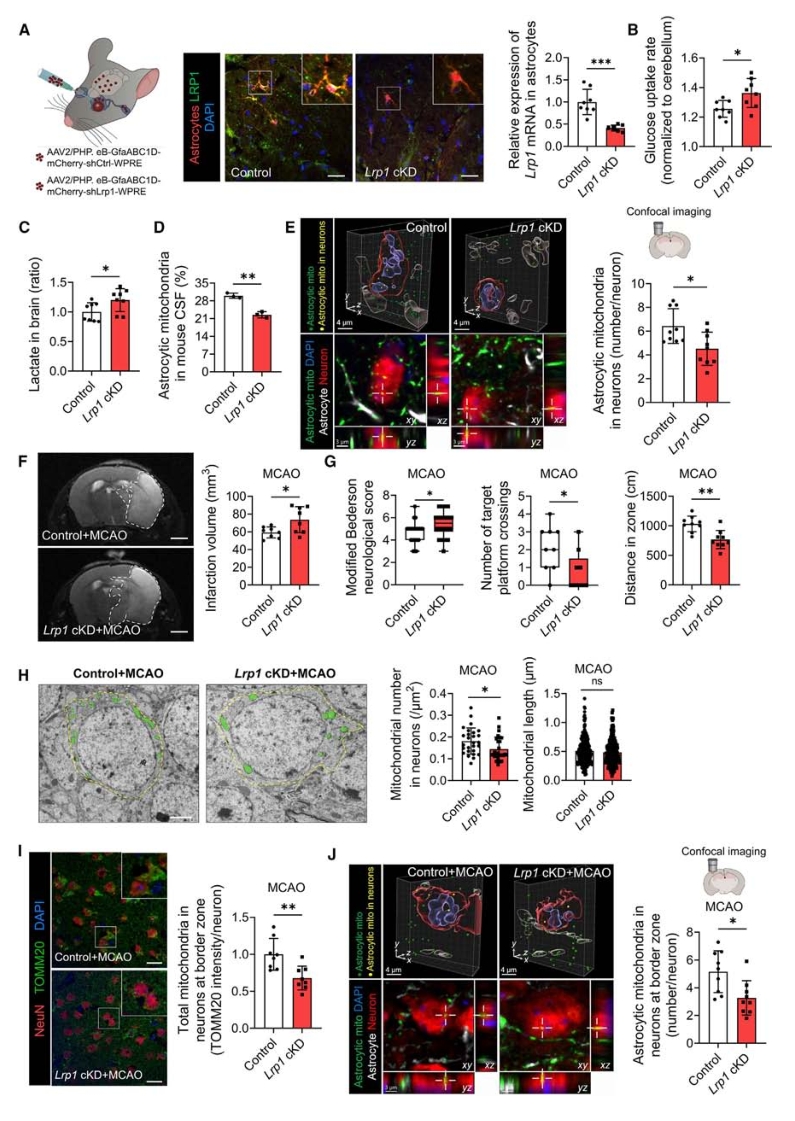
5. 体内验证LRP1-乳酸轴与线粒体转移和脑损伤的关系
最后进行动物模型验证,采用大脑中动脉闭塞术(MCAO)构建小鼠脑缺血再灌注(I/R)损伤模型,发现敲减LRP1的小鼠在MCAO手术后脑梗死区域更大,神经功能也更差。此外,在梗死区域边缘的神经元内线粒体数量、特别是来自星形胶质细胞的线粒体减少,并且这些神经元的线粒体功能受损。
图6. LRP调控的星形细胞线粒体转移可减轻脑I/R损伤
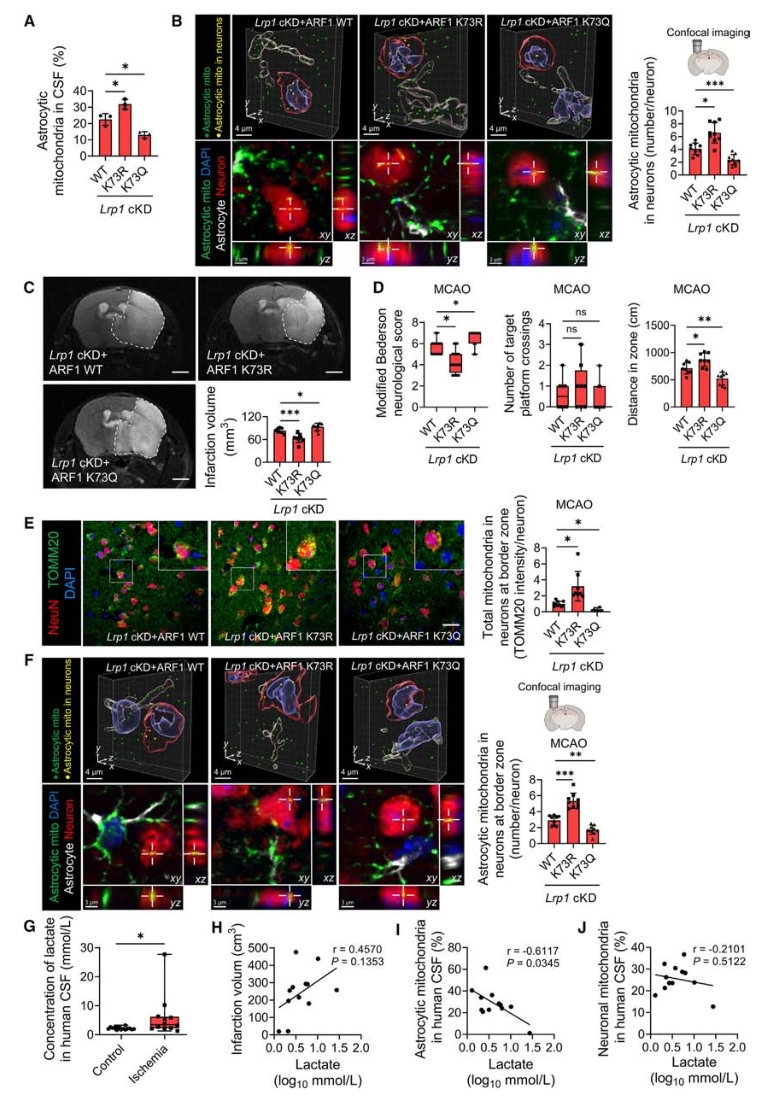
随后进一步测试了上述脑损伤过程中ARF1-K73乳酸化的作用。首先,分别对LRP1特异性敲减的小鼠进行K73Q和K73R过表达造模,发现与对照相比,K73R过表达小鼠脑脊液和神经元中星形胶质细胞来源的线粒体更多,K73Q过表达组则与之相反。随后再次进行MCAO诱导的脑损伤实验,发现与对照组相比,K73R处理组小鼠梗死面积减少,神经功能改善,星形胶质细胞来源的线粒体数增加,而K73Q处理组的表型变化与之相反。
为了确定上述研究结果的临床相关性,研究者量化了人类卒中患者和正常受试者的脑脊液乳酸水平,发现与正常对照相比,缺血性脑卒中患者脑脊液乳酸水平明显升高,且乳酸水平与梗死面积呈正相关,而与脑脊液星形细胞线粒体呈负相关。
图7. 星形胶质细胞的ARF1-K73乳酸化会减少线粒体转移,从而加重脑I/R损伤
以上结果支持了乳酸可降低线粒体转移并加重脑I/R损伤的结论。
研究结论
本研究使用体外细胞实验、稳定同位素示踪(代谢流)检测和乳酸化修饰蛋白质组学检测等技术方法,研究了星形胶质细胞LRP1调节健康线粒体从星形胶质细胞向神经元的转移,并保护免受脑缺血再灌注(I/R)损伤的现象。在机制方面发现了乳酸盐抑制功能性线粒体转移并加重I/R损伤。
本研究为理解线粒体稳态缺血性卒中发生发展过程中的作用机制提供了新的视角,为开发缺血性卒中的治疗提供了新的策略。
图8. 全文总结
参考文献
Zhou J, Zhang L, Peng J, et al. Astrocytic LRP1 enables mitochondria transfer to neurons and mitigates brain ischemic stroke by suppressing ARF1 lactylation. Cell Metab. 2024.
请扫描二维码阅读原文
绘谱帮你测
麦特绘谱为本研究提供[U-13C]葡萄糖、[U-13C]L-谷氨酰胺、[U-13C]乙酸代谢流检测技术。本公司开创性地搭建了医学领域高端代谢组学技术平台,覆盖了非靶向-全定量-代谢流等全方位的高端医学代谢组解决方案,同时全面布局微生物组学、转录组学和蛋白质组学等多组学技术服务,已成为全球多组学研究者的优选合作伙伴。麦特绘谱拥有Q1000,Q500、Q300、Q200和胆汁酸、短链脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO类等各类小分子代谢物、非靶向代谢组学和同位素示踪代谢流技术等共40+系列检测方法;已为数百家三甲医院、科研院所和企业提供多组学解决方案,协助客户与合作伙伴发表SCI文章400+篇,累计影响因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等顶级期刊。
END