DNA 双链分子在全长不断增加温度或用化学变性剂条件处理下,两条链就会开始分开(即解链)。首先解链的区域由解链温度较低的碱基组成。GC碱基对比AT碱基对结合得要牢固,因此GC含量高的区域具有较高的解链温度。同时影响解链温度的因素还有相邻碱基间的吸引力。解链温度低的区域,通常位于端部称作低温解链区。如果端部分开,那么双螺旋就由未解链部分束在一起,这一区域便称作高温解链 (图1) 。
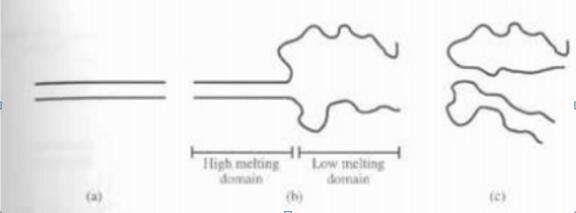
图1
如果温度或变性剂浓度继续升高,两条链就会完全分开。变性梯度凝胶电泳法依据首要的一点是:DNA双链末端一旦解链,其在凝胶中的电泳速度将会极剧下降。第二个根据是,如果某一区域首先解链,而与其仅有一个碱基之差的另一条链就会有不同的解链温度,其电泳速度也会有明显差别。因此,将样品加入含有变性剂梯度的凝胶进行电泳就可将二者分开(图 2, 1 和 2 道)。
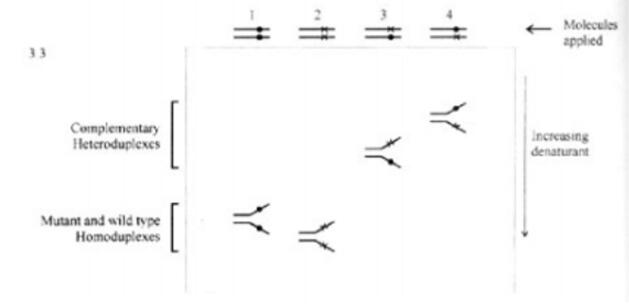
图2
最终,如果一双链在其低温解链区碱基错配(异源双链),而与另一等同的双链相比差别仅在于此,那么,含有错配碱基的双链将在低得多的变性剂浓度下解链。事实上,样品通常含有突变、正常的同源双链以及配对的异源双链,后者是在PCR扩增加时产行的。而含有错配的双链(图2中的3和4道)通常可以远远地与两个同源双链(图2中1和2道)分开,这种分离效果使该方法灵敏度很高。为使仅有一个碱基之差的不同分子取得好的分离效果,必须先选择所要研究的DNA范围以及电泳样品时变性剂浓度梯度。这可以按图 2 所示的正交变性梯度实验进行经验性地解决。变性剂梯度应选在曲线斜率大的部分,因为这时多数分子处于部分变性状态这使得落入低温解链区的不同分子达到较佳分离。
现在多数分析实验是加入了“GC夹板”(clamp)。它是将一段长度为30-50碱基,富含GC的DNA 附加到双链的一端以形成一个人为高温解链区。这样,片段的其他部分就处在低温解链区从而可以对其进分析。
实验材料
1、实验仪器:电泳控温槽一台、电泳支架、程控电泳仪、梯度混合仪一套、缓冲液虹吸泵、凝胶成像仪;
2、实验试剂:
(1)40%的凝胶单体(丙烯酰胺/甲叉双丙烯酰胺:37.5/1):称取38.93g丙烯酰胺和1.07g甲叉双丙烯酰胺,加入去离子水定容至100ml后用0.45μm的滤膜过滤后装入棕色瓶4°C保存。
(2)100%变性剂:取42ml去离子甲酰胺、42g尿素,用去离子水定容至100 ml后用0.45μm的滤膜过滤后装入棕色瓶4°C保存。
(3)50×TAE缓冲液(Tris 2mol/L, 冰醋酸 1mol/L,EDTA 50mmol/L,pH8.0) ;
(4)10%过硫酸铵溶液(W/V,为保证良好的引发效果,建议现配现用) ;
(5)TEMED(分析纯)。
(6)梯度变性胶的配方(浓度为8%的变性胶)
|
组分 |
变性剂浓度60% |
变性剂浓度50% |
变性剂浓度25% |
变性剂浓度0% |
|
凝胶单体 |
2.8ml |
2.8ml |
2.8ml |
0.8ml |
|
100%变性剂 |
8.4ml |
7ml |
3.5ml |
0 |
|
50X TAE |
0.28ml |
0.28ml |
0.28 |
0.08ml |
|
双蒸水 |
2.52ml |
3.92ml |
7.42ml |
3.12ml |
|
10%过硫酸铵 |
60ul |
60ul |
60ul |
25ul |
|
TEMED |
8ul |
60ul |
60ul |
5ul |
|
总体积 |
14ml |
14ml |
14ml |
14ml |
(6)梯度变性胶的配方(浓度为6%的变性胶)
|
组分 |
变性剂浓度60% |
变性剂浓度50% |
变性剂浓度25% |
变性剂浓度0% |
|
凝胶单体 |
2.1ml |
2.1ml |
2.1ml |
0.6ml |
|
100%变性剂 |
8.4ml |
7ml |
3.5ml |
0 |
|
50X TAE |
0.28ml |
0.28ml |
0.28 |
0.08ml |
|
双蒸水 |
3.22ml |
4.62ml |
8.12ml |
3.32ml |
|
10%过硫酸铵 |
60ul |
60ul |
60ul |
25ul |
|
TEMED |
8ul |
60ul |
60ul |
5ul |
|
总体积 |
14ml |
14ml |
14ml |
14ml |
实验过程
1、将两块玻璃对齐放入电泳支架上(带缺口的玻璃缺口朝上并位于内侧),旋紧固定螺丝并夹好夹子。注入去离子水,检测是否漏水后倒出去离子水。
2、配制高变性剂浓度凝胶溶液和低变性剂浓度凝胶溶液,在灌胶前加入适量的10%过硫酸铵溶液和TEMED作为聚合引发剂和催化剂并充分混匀。关闭梯度混合仪的两个阀门,将高浓度变性剂凝胶溶液加入梯度混合仪靠近出口的一端,将低浓度变性剂凝胶溶液加入另一端,并打开磁力搅拌器。
3、先打开梯度混合仪出口端阀门,待液流稳定无气泡时将针头插入两块玻璃缝隙中部,接着打开梯度混合仪中间阀门开始灌胶。
4、待凝胶灌至距上端1.5cm处时停止灌胶,加入1mL去离子水液封胶面,待凝胶聚合后,配制不含变性剂的0%凝胶,用移液器灌胶,插好梳子,待凝胶完全聚合。
5、拔出梳子,将电泳支架放入恒温电泳槽,将各个PCR产物与Loading buffer混匀,然后用微量上样器吸取样品并加到各个上样孔中(每个孔的DNA含量为500-800ng,PCR产物在琼脂糖电泳时与Marker比较计算其大概含量,使得梯度变性胶每个孔样品中的DNA含量尽量一致)。 一切就绪后,准备开始电泳,电压设定为第一阶段60V,时间1h 第二阶段100V,时间16h,电泳仪全自动定时分段编程。
地 址: 高新区港源四路416号 联系人: 展经理 电 话: 400-077-2566 传 真: 0531-88896821 Email:market@wzbio.cn
CANCER IMMUNOL RES|揭秘抗PD-1免疫治疗肝细胞癌的耐受新机制(腺病毒感染巨噬细胞BMDMs)
(2024-11-18T00:00 浏览数:2747)
江沛教授团队发现小胶质细胞AKAP8L可能是糖尿病相关认知障碍的治疗靶点
(2024-11-11T00:00 浏览数:3991)
AAV在内耳的靶向应用策略(下)(AAV血清型、载体)
(2024-11-04T00:00 浏览数:4223)
IF 40.8|郑乐民/刘东辉/徐勇研究团队联合揭示ANXA1是预防和治疗肥胖的潜在靶点!(腺病毒感染脂肪血管基质组分))
(2024-10-28T00:00 浏览数:5464)
IF 40.8|杨吉春/迟毓婧/王国庆/刘兴凯团队揭示RIMKLA-BHMT1轴改善肝脏脂肪变性的机制
(2024-10-14T00:00 浏览数:6798)
Cell Death and Disease|吉林大学第一医院尉海涛团队揭示Kat2a-铁死亡轴在糖尿病心肌病发病机制中的新作用
(2024-10-08T00:00 浏览数:9213)
AAV在内耳的靶向应用策略(上)(特异性启动子、注射方式)
(2024-09-29T00:00 浏览数:10711)
Nature Metabolism IF18.9| 浙江大学联合国外多研究团队揭示ATGL的S酰化调控脂滴稳态机制
(2024-09-23T00:00 浏览数:12306)
IF 16.7|杨吉春/迟毓婧/刘兴凯团队揭示FAM3A通过PANX1调控ATP释放改善肝脏糖脂代谢的新机制
(2024-09-18T00:00 浏览数:13548)
项鹏/夏凯团队通过AAVDJ基因治疗恢复LCF小鼠的自然生育能力并改善身体功能
(2024-09-09T00:00 浏览数:15780)
山东维真生物科技有限公司
商家主页
相关咨询
