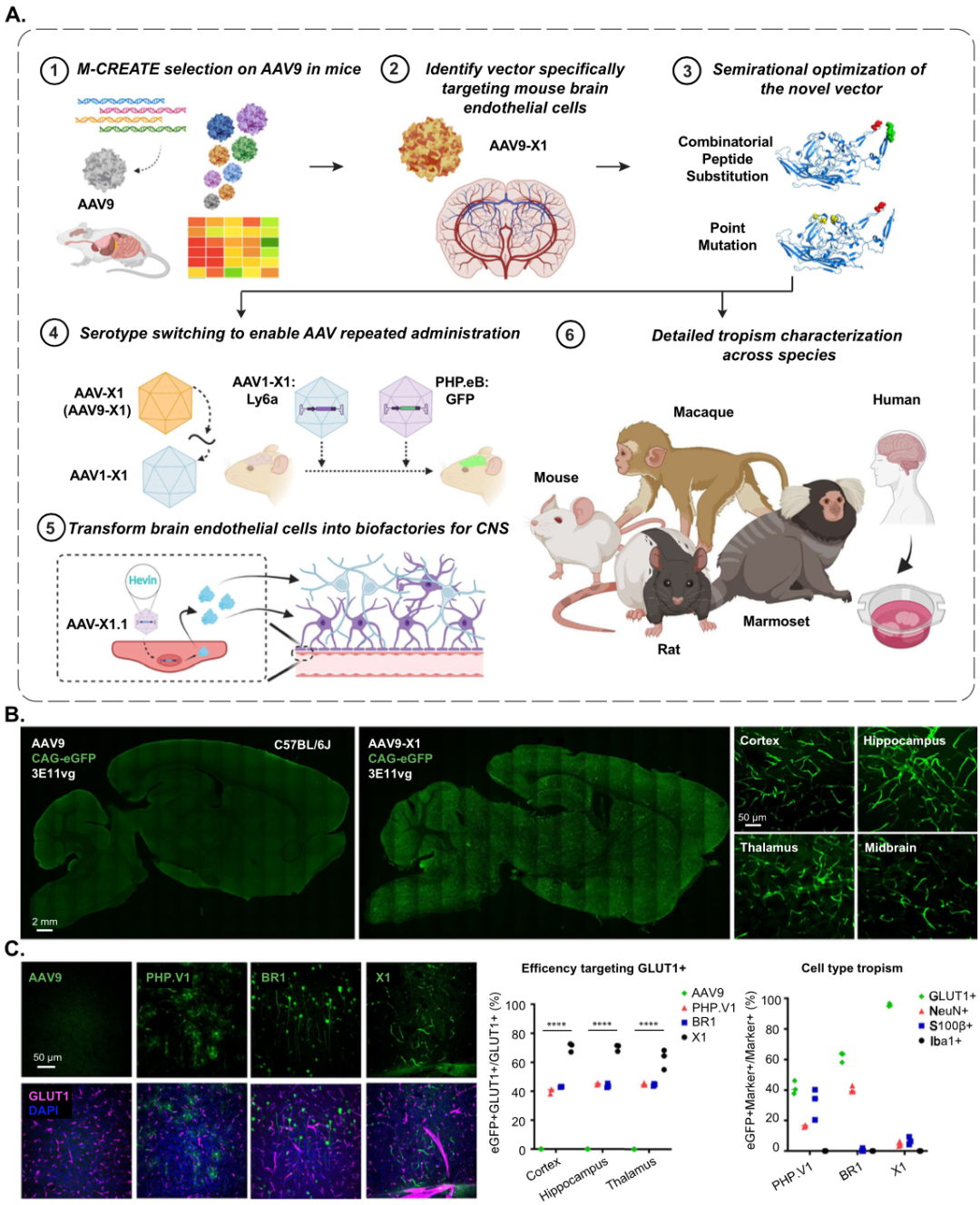
加州理工学院Viviana Gradinaru团队之前开发了AAV变体,例如AAV-PHP.eB,其在啮齿动物中可通过静脉注射有效穿越血脑屏障,对大脑细胞具有广泛靶向性。她的团队还开发了一些具有细胞类型特异性靶向的AAV变体,例如PHP.V1,其可通过静脉注射穿越血脑屏障,对大脑内皮细胞具有更强的靶向,但也会靶向星形胶质细胞和神经元,此外,PHP.V1需要细胞类型特异性启动子,其大尺寸限制了用来递送基因时的选择,并且仅在某些小鼠品系中起作用。
基于AAV的基因递送还面临一个问题——难以重复给药,第一次给药后诱导产生的中和抗体可能会导致重复给药的AAV被中和。这就需要在第一次给药时尽可能地提高治疗效果。作为最主要的体内基因治疗递送载体,AAV载体已被用于递送多种基因以治疗不同类型的疾病。一种对大脑脉管系统具有特异性靶向的AAV将为基因治疗提供新的策略。这是因为脉管系统在大脑中广泛分布,且与中枢神经系统内的其他细胞类型接近。因此,AAV靶向大脑脉管系统可以作为中枢神经系统更好的生物工厂,用来表达治疗性蛋白,以治疗中枢神经系统疾病。在这项新研究中,研究团队通过定向进化和半理性工程设计,确定了一个基于AAV的家族,包括AAV-X1和AAV-X1.1,它们能够在小鼠体内特异性和有效地靶向大脑脉管系统内皮细胞。下面,让我们一起来简读一下Viviana Gradinaru团队的杰作:Functional gene delivery to and across brain vasculature of systemic AAVs with endothelial-specific tropism in rodents and broad tropism in primates.
AAV面临几大挑战:1.如何有效的穿过血脑屏障,AAV-PHP.eB已经解决[1];2.靶向的精准性?脑内皮细胞,可以选择AAV-BR1这个血清型,但是除了内皮细胞外,也会转染大量神经元和胶质细胞[2];3.AAV在不同物种间存在转染效率的差异,所以在临床转化的过程中,将AAV在非人灵长类动物(NHPs)中的在体实验纳入到整体实验进程中是必要的;4.AAV二次给药,会被抗体中和,而且单次、大剂量的AAV,毒副作用也相应增加。所以带着这些问题,我们一起来看一下Viviana Gradinaru团队的解决方案。
Result 1:新型AAV系统性注射后,特异性靶向小鼠脑内皮细胞
作者在AAV9的588-589碱基中插入小分子多肽(7个氨基酸),并将得到的病毒文库静脉注射到表达来自Tek(靶向内皮细胞)启动子的Cre转基因鼠中。经过两轮筛选,筛出了AAV-X1,为了比较新血清型间的差异,作者将单链AAV中,包装了广谱启动子CAG和EGFP,四种血清型分别为AAV-X1、AAV9、AAVPHP.V1、AAVBR1,尾静脉注射剂量为3E+11vg/只。标记效率比较结果显示:①AAV-X1在皮层、海马和丘脑中转导了约65-70%的GLUT1+(内皮标志物)细胞;②AAV-PHP.V1和AAV-BR1转导了约40%的GLUT1+细胞;③AAV9转导了约1%的内皮细胞。特异性结果显示:95%被AAV-X1转导的细胞为GLUT1+。相比之下,AAV-BR1和AAV-PHP.V1转导的GLUT1+细胞特异性要低得多,分别只有60%和40%的转导细胞是GLUT1+。AAV-BR1也靶向神经元,而AAV-PHP.V1也靶向神经元和星形胶质细胞。综上所述,与亲本载体AAV9相比,新载体AAV-X1不仅对中枢神经系统的靶向性有显著提高,而且对脑内皮细胞具有较高的特异性。
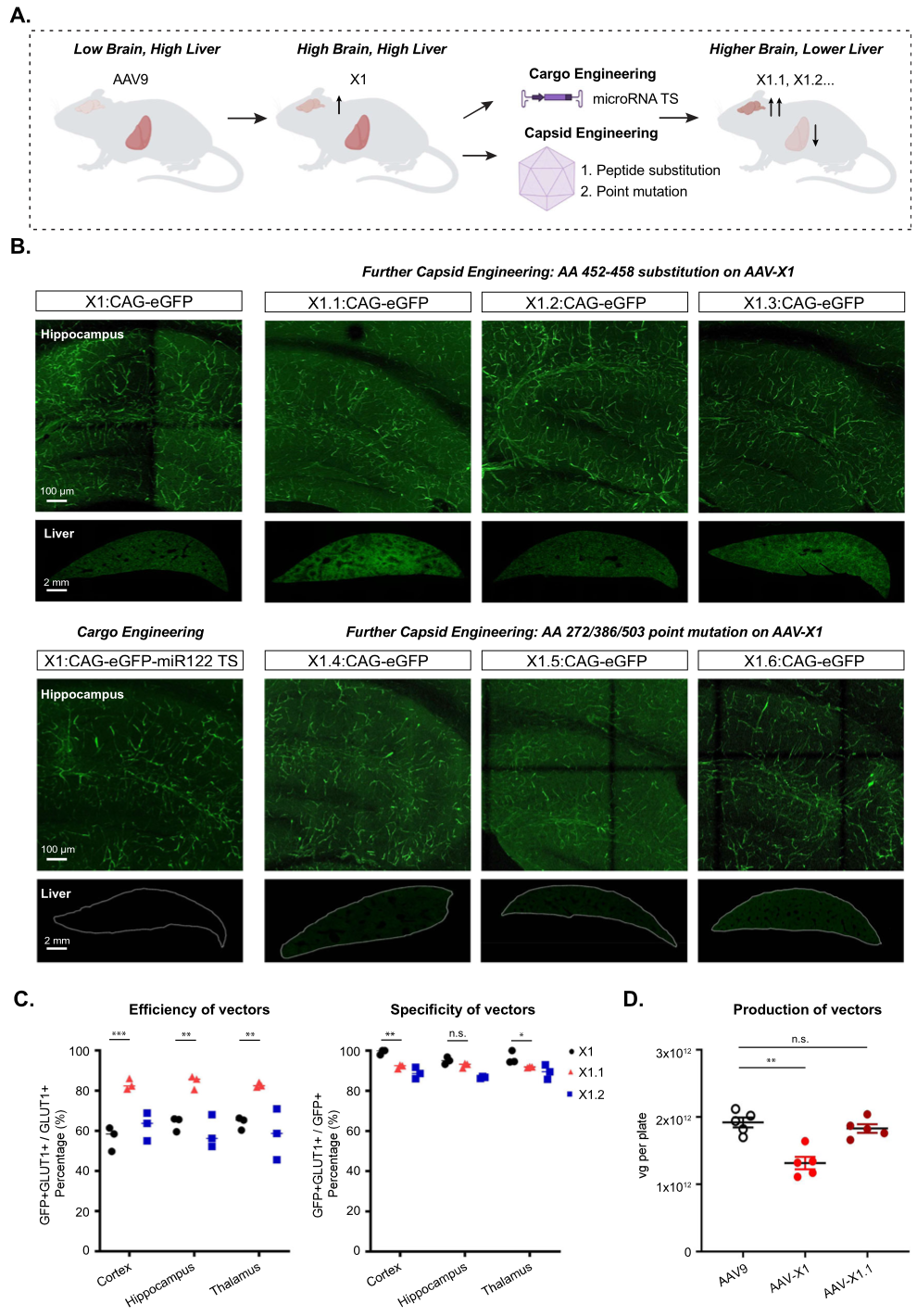
Result 2: 通过进一步的工程Cargo对X1的外周嗜性进行半理细化
AAV-X1展现脑内皮细胞极高的转导效率的同时,也保持了相似的肝脏转导水平(Figure 2A)。MicroRNA-122 (miR122)对肝脏具有高度特异性,其干扰靶点已被证明可降低肝脏中AAV的表达[3],于是作者将miR122的3个干扰靶点,串联(miR122TS)构建在AAV-X1-CAG-EGFP中,尾静脉注射后3周,观察结果显示:AAV-X1-CAG-miR122TS-EGFP,在肝脏中表达明显降低(Figure 2B)。进一步,作者将AAV-PHP.eB中,452-458的小分子多肽(7个氨基酸),插入到AAV-X1,构建了载体AAV-X1.1、AAV-X1.2、AAV-X1.3;此外,作者将AAV-X1中的N272或W503突变为丙氨酸,产生AAV-X1.4和AAV-X1.5,将AAV-X1中的S386突变为丙氨酸,产生AAV-X1.6。
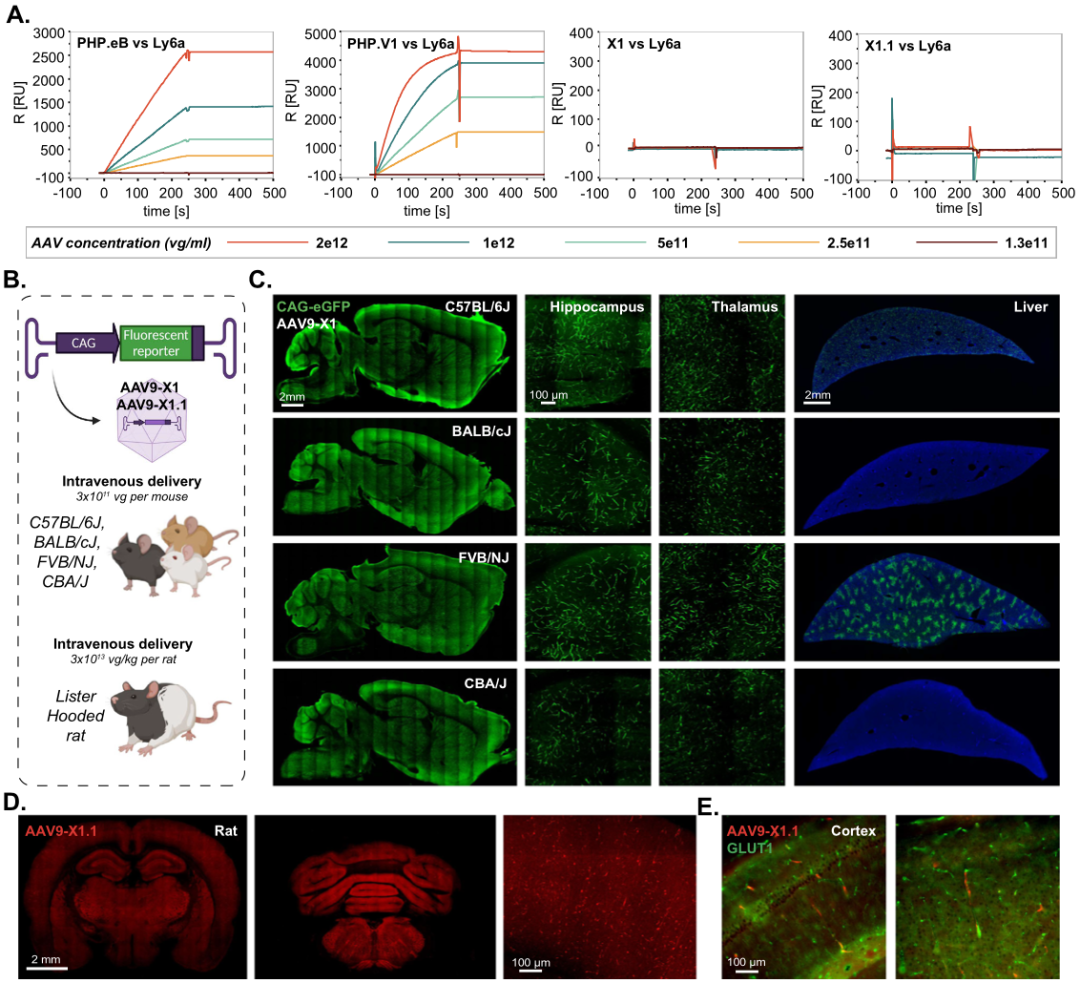
Result 3: X1载体以不依赖ly6a的方式在不同小鼠品系和大鼠之间转导脑内皮细胞
作者前期的研究结果显示:AAV-PHP.eB与Ly6a结合,可以增加中枢神经系统的嗜性,并且Ly6a在小鼠品系之间的多态性有助于其品系特异性表型。为此,作者想探究AAV9-X1的CNS靶向性是否也依赖与Ly6a结合,测试结果显示:PHP.eB和PHP.V1表现出与Ly6a的强结合,解释了PHP的菌株特异性表型;而X1和X1.1均未结合Ly6a(Figure 3A)。这些结果表明X1及其衍生物利用了一种新的细胞靶向机制。
接下来,作者测试了AAV9-X1.1-CAG-tdTomato,在成年Listar大鼠中的递送效率,观察到载体在大鼠脑中强劲表达(Figure 3D)。复染Glut+后,证明AAV9-X1.1在不同物种间是保守的(Figure 3E)。
Result 4: 将X1的血清型从AAV9转换为AAV1,可以在小鼠中重复给药
某些应用需要重复递送AAV,首次给药产生的中和抗体,会影响二次给AAV的递送效率。为了解决这一问题,作者给出的策略是更换血清型,鉴于AAV-PHP.eB和AAV9-X1都是基于AAV9改造的,所以为了克服潜在的免疫障碍,作者将PHP.B血清型中的小分子多肽(7个氨基酸)构建到AAV1中:AAV1-PHP.B(Figure 4B),与AAV1相比,AAV1-PHP.B并没有明显的靶向性,然而相同的策略,作者将小分子多肽(7个氨基酸)肽插入到AAV1-X1中,AAV1-X1同样显示出强大的脑血管内皮靶向性(Figure 4C)。
为了测试AAV1-X1重复给药的潜力,且增加中枢靶向性,作者将AAV1-X1-Ly6a或AAV1.1-X1-Ly6a,注射到CBA/J小鼠中,表达3周后,再次将AAV-PHP.eB-CAG-EGFP注入相同小鼠。结果显示注射了AAV1-X1: CAG-Ly6a的CBA/J小鼠大脑中的EGFP表达增加,而注射了X1.1: CAG-Ly6a的小鼠则没有,说明AAV1-X1激活的血清型转换模式可能为小鼠的AAV再给药提供了潜在的解决方案。
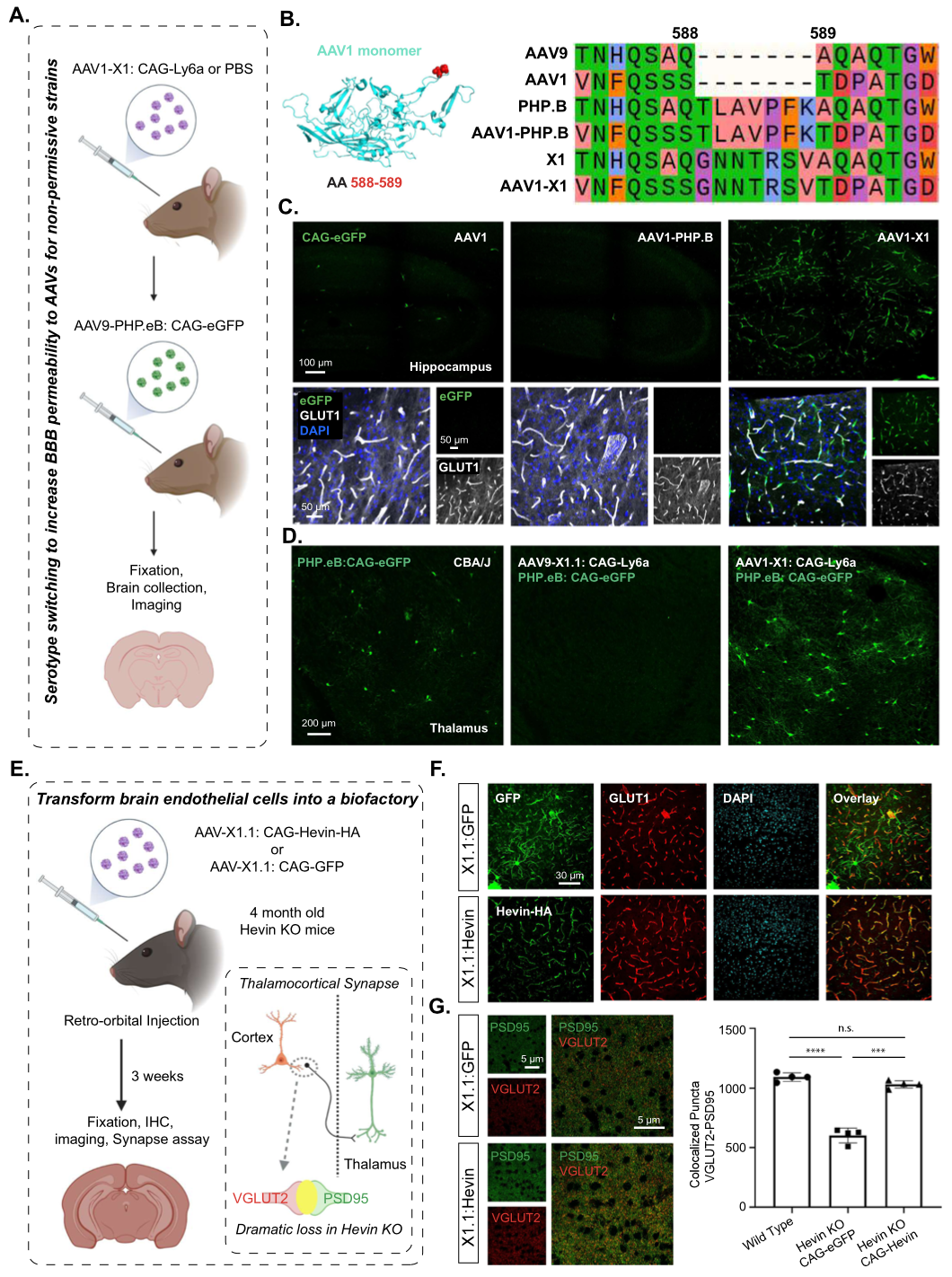
Result 5: X1.1载体可以将脑内皮细胞转化为一个生物工厂,用于将分泌的蛋白质输送到大脑
血管在脑区各个角落的分布,使脑血管内皮细胞称为“生物工厂”成为可能。
SPARCL1/Hevin基因的下调或错义突变在许多神经系统疾病中都有报道,如自闭症、精神分裂症和抑郁症。在发育中的小鼠视觉皮层中,Hevin对于丘脑皮质连接的形成和可塑性是特别需要的。Hevin基因敲除小鼠(Hevin KO)在出生后的前三周和成年后都表现出明显的谷氨酸偶体转运蛋白2阳性(VGluT2+)丘脑皮质突触的缺失(Figure 4E)。为了确定脑内皮细胞异位表达Hevin是否可以挽救Hevin-KO小鼠的缺陷,作者使用AAV9-X1.1-CAG-Hevin-EGFP的载体,尾静脉注射Hevin-KO小鼠,3周后,结果显示:在脑内皮细胞中,Hevin蛋白稳健而特异性的表达(Figure 4F)。结果表明,由脑内皮细胞产生和分泌的Hevin能够模拟内源性Hevin功能,挽救Hevin-KO小鼠严重缺乏的丘脑皮质突触形成。因此,该系统说明了Hevin相关疾病的潜在治疗策略。
Result 6: X1载体家族在体外有效地转导人脑内皮细胞
AAV9-X1感染内皮细胞(HBMECs)在MOI为3*104时,X1转导了42%的HBMEC,比亲本AAV9高180倍。进一步设计的版本X1.1和X1.2分别转导了44%和53%的HBMEC。
Result 7: X1.1有效地转导体外培养的猕猴和人脑切片
AAV9-X1在HBMECs中的强大表现促使我们研究它们在系统中的功效,该系统可能更好地模拟非人灵长类动物体内条件。因此,作者转向体外脑切片培养系统(Figure 5B)。这些切片是从灵长类动物(长尾猕猴,Macaca Nemestrina)的大脑中新鲜提取的,并在体外培养。
7-10天后,我们从组织中提取DNA和RNA,并使用下一代测序(NGS)计算组织中AAV库中变体的富集程度。与AAV9相比,X1.1的DNA和RNA分别增加了4倍和25倍。值得注意的是,在离体脑切片中,X1.1诱导的蛋白表达主要见于神经元。结果说明:X1.1在猕猴和人类离体切片中的强劲表现(Figure 5F)表明,该衣壳在未来的转化中具有巨大的潜力。
Result 8: X1.1在静脉给药后有效靶向恒河猴的中枢神经系统
完成了AAV9-X1.1在离体NHP和人脑模型中转导效率的验证后,作者进行了猴的体内实验。作者同时测试了AAV9-CAG-EGFP与AAV9-X1.1-CAG-EGFP,两种载体在新生恒河猴,每只猴5E+13vg/kg,表达4周后,作者观察到与AAV9相比,X1.1在包括皮层、舌回(LG)、海马和小脑在内的大脑区域有较强的表达(Figure 6B),进一步的免疫组化染色显示,皮层中约98%的X1.1转导细胞是神经元,而一小部分靶向细胞是内皮细胞或胶质细胞(Figure 6D、E)。X1.1的神经元转导比AAV9高约45倍(Figure 6F)。
新生猕猴中X1.1的嗜神经谱与啮齿动物中X1.1的嗜内皮细胞谱之间的差异开辟了潜在的应用,并强调了跨物种分析AAV载体的必要性。这些实验表明,新的衣壳AAV-X1.1可以有效地转导旧大陆猴幼猴的中枢神经系统,使其成为研究神经系统疾病的潜在有用载体。
小 结
本文讲解了一款新载体AAV-X1.1,尚未搭配内皮细胞的特异性启动子的时候,就已经展现出强劲的血管内皮细胞的精准靶向性。后续的吉凯内部测试中,如果新载体AAV-X1.1,搭配上特异性启动子(TIE或ICAM2),相信会有更好的效果。此外,作者还通过更换血清型,解决了中和抗体,影响AAV二次给药的难题。
目前吉凯基因正在生产AAV-X1.1的试用装,内部测试后,将会推广给老师们使用。
[参考文献]:
1. Chan, K. Y. et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nat. Neu- rosci. 20, 1172–1179 (2017).
2.Ravindra Kumar, S. et al. Multiplexed Cre-dependent selection yields systemic AAVs for targeting distinct brain cell types. Nat. Methods 17, 541–550 (2020).
3.sakova, A., Fehlmann, T., Keller, A. & Quake, S. R. A mouse tissue atlas of small noncoding RNA. Proc. Natl Acad. Sci. USA 117, 25634–25645 (2020).
