神经性厌食症(Anorexia nervosa, AN)简称为厌食症,是一种严重的精神疾病和进食失调症,病例以女性为主。AN发病机制涉及遗传和各种环境因素,已有研究推测异常的肠道微生物群可能与AN的发病机制有关,但确切的病因尚不清晰。

近日,哥本哈根大学等单位的相关研究人员通过对AN临床队列人群开展菌群测序与血清代谢组学,并结合动物实验阐释了AN肠道微生物群和相关代谢物在AN发病机制中的作用影响,揭示了AN中改变的肠道微生物群与AN表型之间的因果关系,将题为“The gut microbiota contributes to the pathogenesis of anorexia nervosa in humans and mice”的研究成果发表在Nature Microbiology(IF: 31.0)杂志。
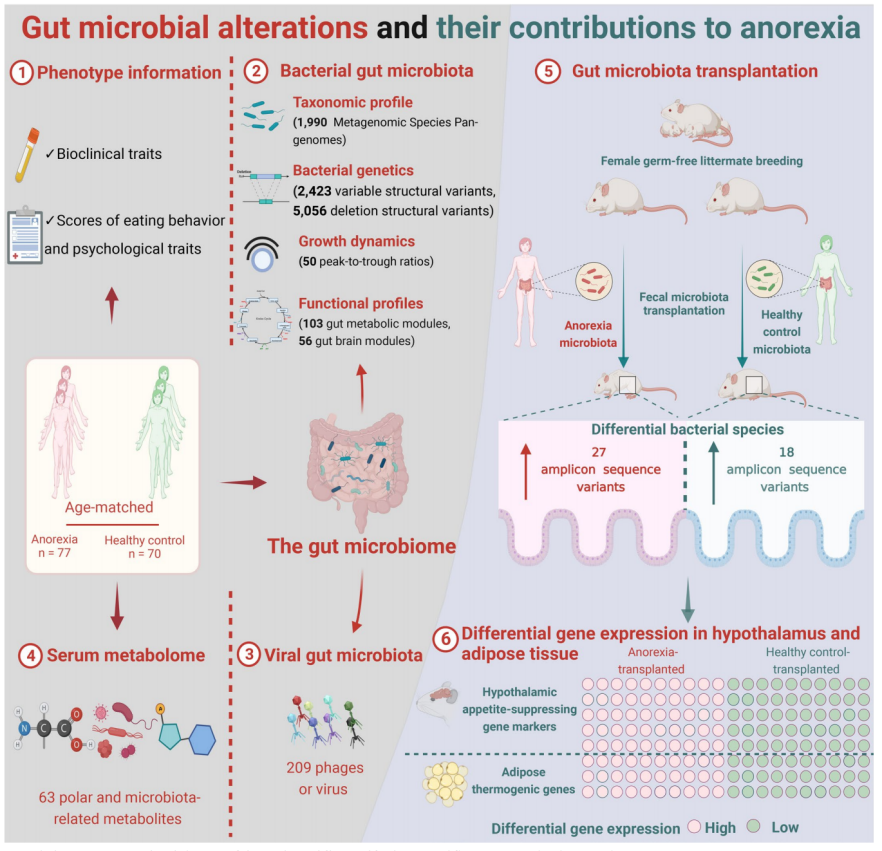
图1. 研究流程图
AN患者改变的肠道微生物群组成与临床变量相关
收集77名AN女性患者和70名健康女性(HC)粪便样本进行宏基因测序,结果表明AN患者的肠道微生物群在属水平上的β多样性更高,且乳酸杆菌在AN中的富集最为显著。肠型分析结果发现,与HC相比,AN中瘤胃球菌-肠型(R-肠型)的患病率更高,暴饮暴食或排泄型(AN-BP)中相同肠型的患病率高于限制型(AN-RS)亚型。在物种水平上,AN肠道微生物群同样具有更高的β多样性,且AN-BP亚型在物种水平上比AN-RS亚型具有更多的异质细菌群落。去除多种混杂干扰因素后筛选出AN和HC组间显著差异物种,发现Roseburia intestinalis, Roseburia inulinivorans, Eisenbergiella以及产生丁酸的SS3/4 – (Clostridium) sp. CAG:81等菌种在HC组中拥有显著高丰度;Erysipelatoclostridium ramosum, Enterocloster bolteae, (Clostridium) innocuum和Blautia sp. CAG:257在AN组中高度富集。
使用线性回归模型调整包括年龄、吸烟和多种药物摄入在内的混杂因素后,研究HC和AN联合队列中属和物种水平上菌群绝对丰度与生物临床变量之间的数值关联。结果表明,梭状芽胞杆菌物种与饮食失调评分呈正相关;在与饮食失调评分呈负相关的细菌物种中,嗜酸乳球菌的绝对丰度和粪杆菌都与抑郁症状和人际疏远的评分有关;Parasutterella的绝对丰度与身体不满意度正相关,双歧杆菌的与完美主义的标志物相关。
菌群生长速率评估显示,AN和HC的峰谷比中位值差异显著,产生丁酸盐的6种菌群在AN中的生长速度显著降低。
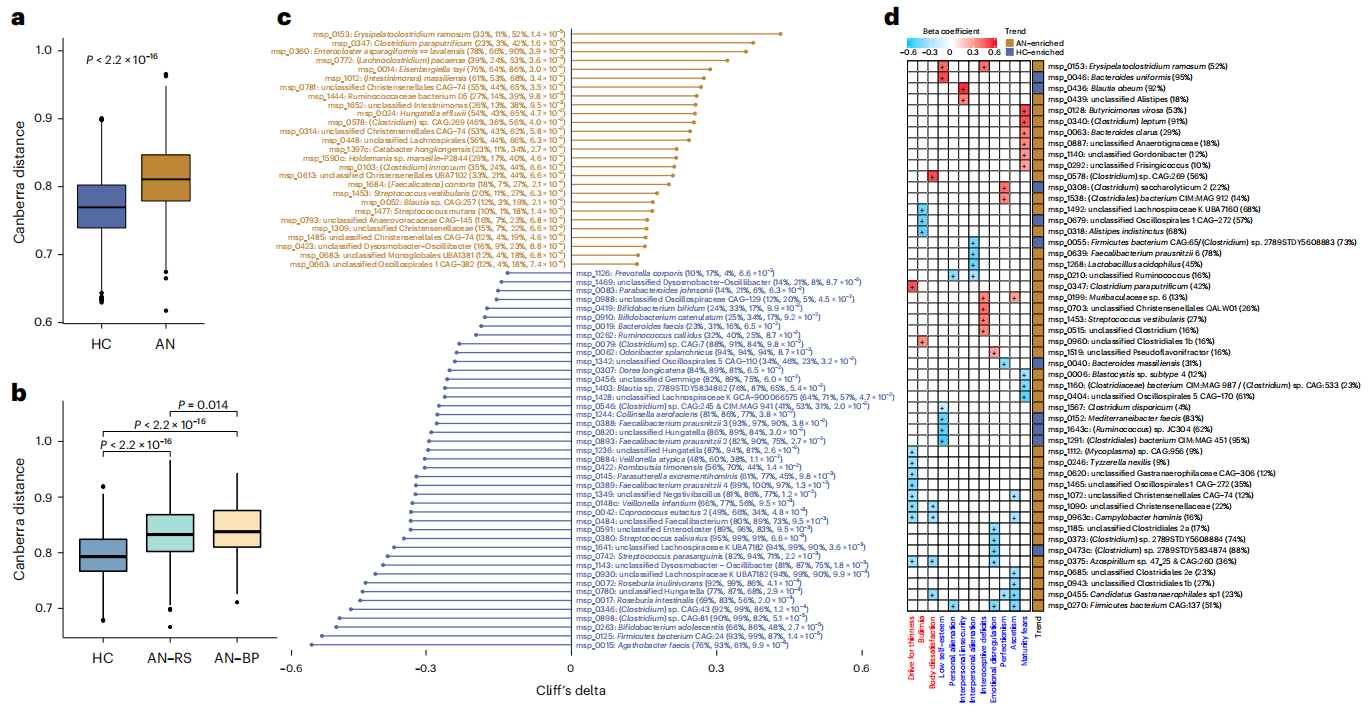
图2. AN患者肠道微生物群组成变化与临床变量相关
预测的肠道微生物群功能与饮食行为和新陈代谢相关
使用肠道代谢模块(GMM)和肠脑模块(GBM)预测肠道菌群的功能潜力,最终确定了159个功能模块,其中用于血清素生物合成的GBMs的丰度以及多巴胺、谷氨酸和色氨酸的降解(对情绪和食欲有影响的代谢物)在AN中富集;谷氨酸合成II和维生素K2途径的丰度在HC中更高;血清素合成和谷氨酸降解途径与葡萄糖和胰岛素的循环浓度或胰岛素敏感性呈负相关。
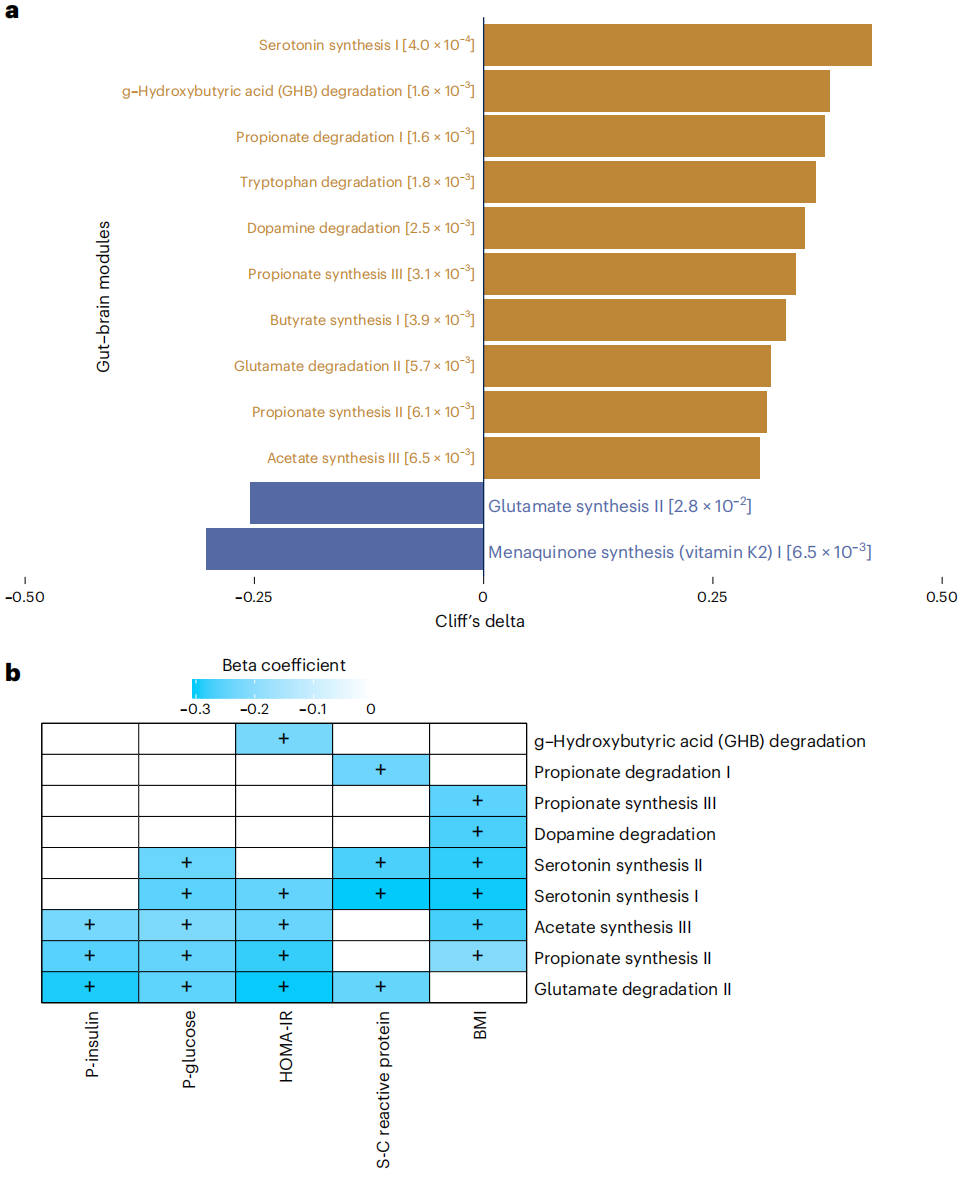
图3. AN肠道微生物群功能预测
菌群基因组可能具有结构变异体(SVs),这些变异可能干扰影响微生物与宿主之间相互作用的功能基因。因此进一步分析所有样本细菌基因组的SVs,最终在在56种细菌中发现了5056个缺失SVs和2423个可变SVs。古细菌微生物群中SVs的鉴定及菌群SVs谱的堪培拉距离、β多样性等结果均指向了两组间菌群SVs的组成不同。
进一步探索肠道细菌SVs与饮食行为标志物之间的关系,发现AN病例中的菌群SVs在去除混杂因素后与饮食失调评分显著相关。在B. uniformis基因组中的SVs与宿主进食评分之间的关联分析中,发现10-kbp缺失与贪食症和自我否定的标志物直接相关,表明这种缺失SVs可能参与AN的调节进食障碍和心理特征。基因分析显示,B. uniformis中特定基因组区域编码参与硫胺素生物合成途径的远端酶。硫胺素缺乏与心理健康有关,大约三分之一的AN病例可能患有硫胺素缺乏症,且缺乏这种菌群基因组区域的AN病例贪食症(AN-BP亚型的关键特征)和自我否定的评分较高。
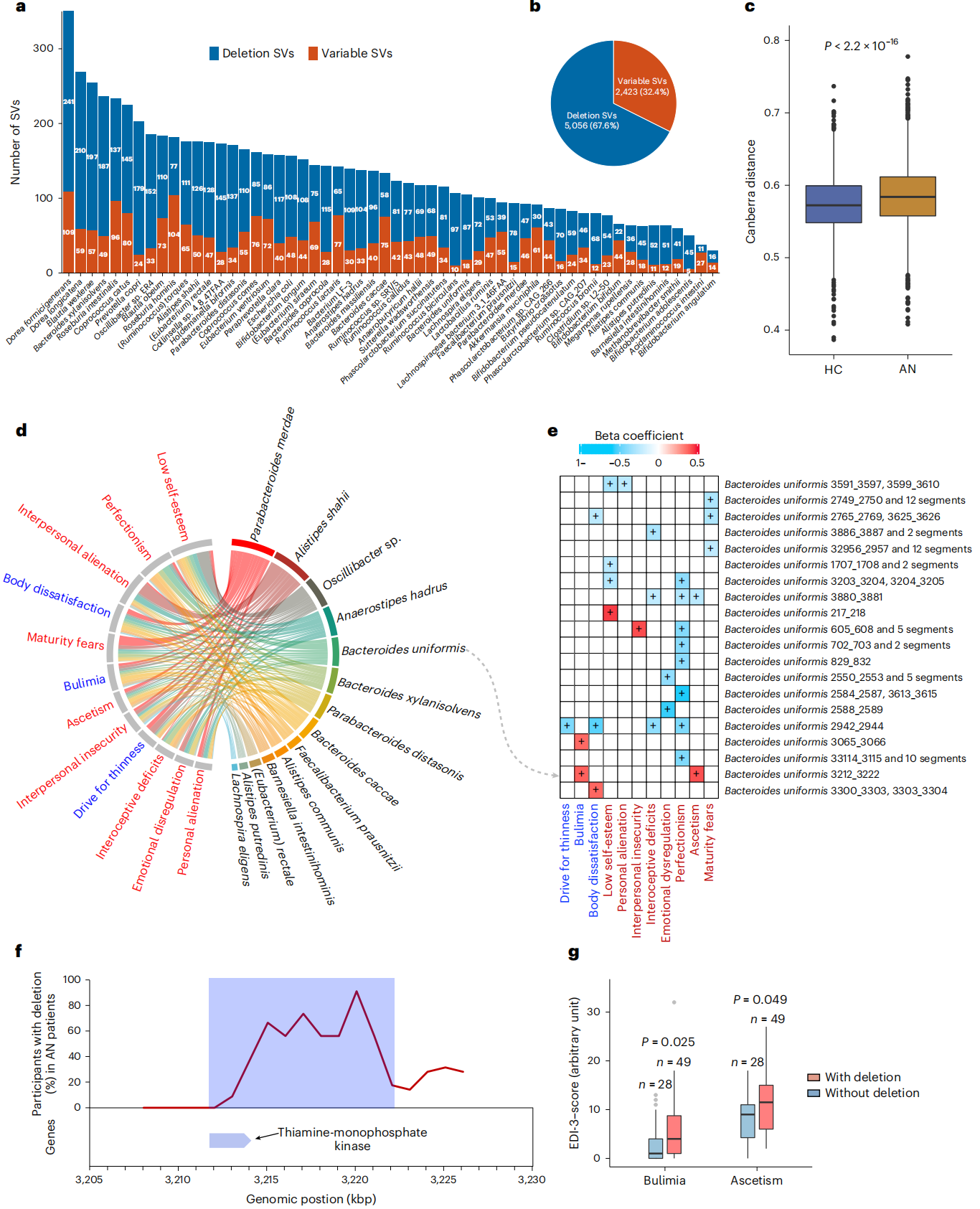
图4. AN与HC组的肠道菌群结构变化
血清代谢物与肠道菌群和进食障碍特征有关
对AN和HC组的血清样本进行非靶向代谢组学分析,最终共计鉴定了28种极性代谢物和35种微生物群相关代谢物。AN和HC组之间代谢轮廓存在显著差异,而两个AN亚型之间仅略有变化。在调整混杂因素后,进一步筛选出25种血清差异代谢物。其中,胆酸(CA)、甘胆酸(GCA)和次级胆汁酸中的甘氧胆酸(GHCA)、7-氧代-莨菪胆酸(7-氧代-HCA)、糖代脱氧胆酸(GHDCA)、7-氧代脱氧胆酸(7-氧代-DCA)、ω/α-穆里胆酸(ω/α-MCA)、熊去氧胆酸(UDCA))的血清浓度较高,表明肠道菌群在继发胆汁酸合成和代谢以及饱腹感调节的AN相关变化中的潜在作用。此外,与HC相比,AN中两种色氨酸代谢物吲哚-3-乙酸和吲哚-3-丙酸(IPA)的血清浓度更高,其中IPA与胰高血糖素样肽1的分泌有关;AN组中的缬氨酸与饱和及长链不饱和脂肪酸的失调有关。
构建双向介导模型以探索血清代谢物在肠道菌群与宿主表型互作中的贡献,最终推断出“瘦身驱动”为AN患者富含细菌物种C. paraputrificum和血清IPA水平的结果;AN患者中富集的硫酸吲哚酯在身体不满意评分中被鉴定为与富含Clostridium sp. CAG:269有关。绘制由14个微生物特征、10个代谢物和5个代谢性状组成的因果网络,发现血清素合成模块通过继发性胆汁酸糖脱氧胆酸对宿主BMI产生因果影响,血清亮氨酸介导了B. vulgatus对葡萄糖稳态的影响。
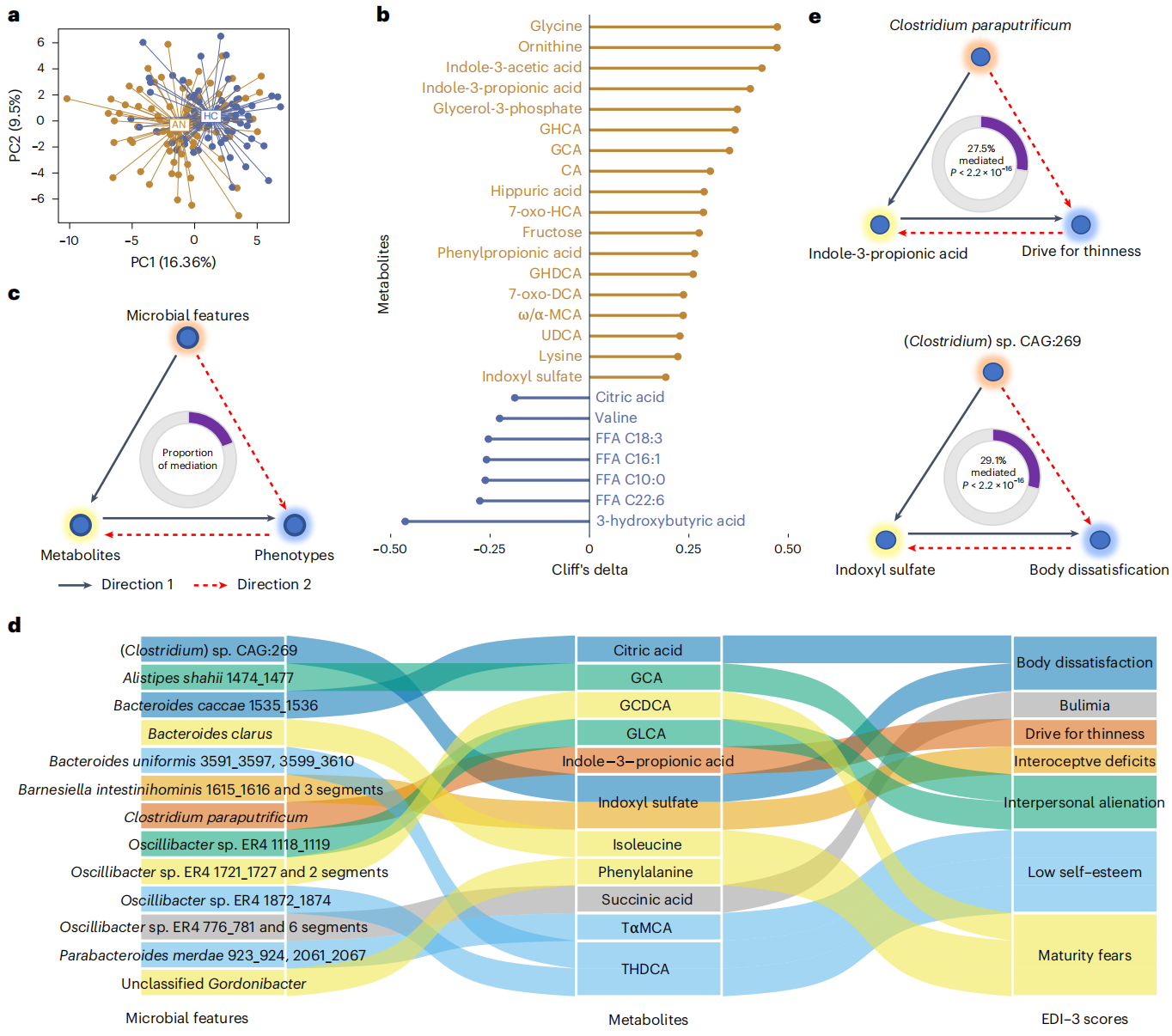
图5. 血清代谢物与肠道菌群和进食障碍特征有关
肠道微生物群诱导小鼠体重增加减少和能量代谢改变
为了研究AN中改变的肠道微生物群与相关表型之间的潜在因果关系,将三个随机选择的AN-RS病例和三个年龄匹配的HC参与者的粪便微生物群移植到雌性无菌(GF)小鼠中,限制喂养小鼠以模拟人类AN中食物摄入量的减少。结果发现,21天后,与接受HC菌粪移植的小鼠相比,接受AN病例粪便移植的GF小鼠显示出更明显的体重初始下降和较慢的体重增加。下丘脑基因表达分析显示AN和HC移植受者在参与控制饮食行为和能量消耗的几种下丘脑基因的表达上存在差异,且AN移植小鼠腹股沟脂肪中Ucp1、Elovl3和Pgc1α的mRNA丰度增加,表明该组小鼠的脂肪组织产热增强。
16S菌群测序显示人供体粪便和GF小鼠受体盲肠内容物测序鉴定出85个重叠扩增子序列变异,其中45个序列在供体中被转移到受体。血清代谢组分析检测到31种代谢物,其中19种从人转移到了小鼠。三种拟杆菌数量与Ucp1表达正相关,表明这些序列通过增强脂肪褐变在体重减轻或降低体重增加方面具有潜在作用。ASV_122的相对丰度(注释为Akkermansia属)与下丘脑食欲抑制基因Htr1b之间的负相关,提示ASV_122在食欲调节中的潜在作用。整体而言,通过小鼠下丘脑和脂肪组织基因表达的改变以及体重随时间的变化揭示了人类AN中肠道微生物群的破坏可能促进AN发病。
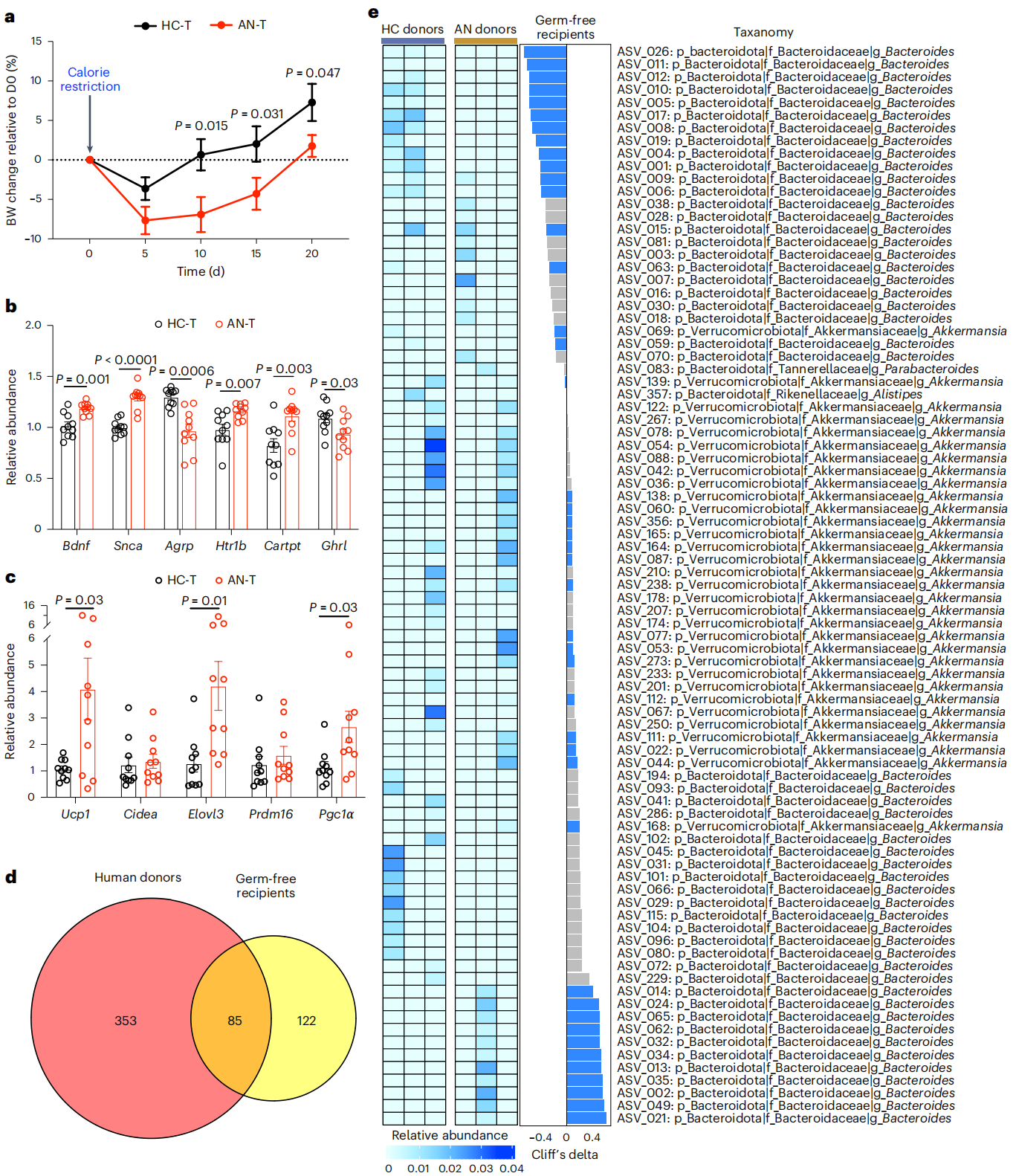
图6. AN与HC菌粪移植后小鼠的表型变化
小结
综上所述,本研究运用菌群测序和代谢组学综合表征了人类和小鼠的肠道微生物组和代谢组图谱,揭示了AN患者肠道微生物群的深刻而复杂的破坏及具有功能意义的血清代谢物改变,小分子代谢物可能通过血液循环或通过肠道-微生物群-脑神经元信号通路起作用,进而影响大脑对食欲、情绪和行为的调节。在能量限制喂养模式下,下丘脑中食欲抑制基因和AN移植小鼠脂肪组织中产热相关基因有关,且这些基因的异常表达、体重改变与异常的能量代谢和饮食行为有关。整体研究表明,严重破坏的肠道微生物组可能导致了AN发病。
参考文献
Fan Y, Støving RK, Berreira Ibraim S, et al. The gut microbiota contributes to the pathogenesis of anorexia nervosa in humans and mice. Nature Microbiology. 2023.
请扫描二维码阅读原文

绘谱帮你测
肠道菌群与宿主之间的共生关系赋予个体健康代谢、免疫和肠道保护功能,微生物的代谢活性可能对宿主健康产生重要影响,因此探究肠道菌群及其代谢物的联系已然成为相关领域的研究热点。本公司经典的已获得客户高度肯定的Q300全定量检测技术和升级的新品Q1000技术以及针对肠菌代谢的宏代谢组技术,均可精确捕捉到肠道菌群代谢途径中所有小分子产物的细微改变,涵盖SCFAs、TMAO类、胆汁酸、吲哚类等诸多肠道菌群相关代谢。目前Q300技术已助力客户在Science, Gut, Advanced Science, Diabetes Care, Nature Communications, PNAS等期刊发表100+篇SCI文章,平均IF>10分。
往期回顾
1. 客户案例 | 谢黎炜团队发现丁酸-Mct1是肠道菌群调控骨骼肌干细胞稳态的关键通路-一条早期预防骨骼肌衰老的新路径
2. Nature Protocols | “肠-脑轴”靶向代谢组学研究–如何破局?
3. 客户案例 | Nature主刊:新机制!肠道菌群如何通过改变饮食成分来影响宿主免疫
4. Nature | 间歇性禁食通过肠道代谢产物3-吲哚丙酸促进神经再生和修复
5. 客户案例 | Nature子刊:重要进展!间歇性禁食或可预防阿尔茨海默病

