随着国内防疫政策的不断优化,加强疫苗接种率成为重中之重。仅一周之内,多款新冠疫苗被纳入紧急使用。日前,沃森生物也在互动平台表示,其新冠mRNA疫苗的国内III期临床试验数据整理及统计分析工作已进入尾声,并已向CDE提交海外III期临床研究首次分析报告,不断推动国内上市进程。
近岸蛋白在推动mRNA疫苗研发生产过程中不断探索创新,于近期又新增两款GMP级限制性内切酶BspQI和XbaI,为客户提供更多的酶切位点选择。
在选择质粒线性化工具时,IIS型限制性内切酶成为mRNA模板制备的好选择,原因是其酶切位点在识别位点以外,酶切后可将Poly A结构直接暴露在3’端而不产生冗余的酶切位点残基,从根本上杜绝多余碱基造成的不确定性。BspQI和BsaI作为一种IIS型限制性内切酶,被广泛应用于mRNA模板制备,其酶切识别位点分别长达7个和6个碱基,具有高度特异性,极不容易在目标序列中出现相同酶切位点,能够有效避免出现非特异性的酶切。
5’...GCTCTTC(N)1↓...3’
3’...CGAGAAG(N)4↑...5’
图一:BspQI酶切识别位点
5’...GGTCTC(N)1↓...3’
3’...CCAGAG(N)5↑...5’
图二:BsaI酶切识别位点
此外,在质粒线性化过程中,还要求酶切产物必须为5’端突出末端,因为如果酶切产生3’突出末端的模板,在体外转录(IVT)时,就会增加副产物dsRNA的生成风险,而dsRNA是一类免疫反应的强刺激物,需要严格控制,才能保证mRNA疫苗的有效性。质粒线性化中,除了上述两种酶,XbaI因其可产生5‘端突出序列也常被应用于生产中。
5’...T↓CTAGA...3’
3’...AGATC↑T...5’
图三:XbaI酶切识别位点
产品特点:
酶切活性高
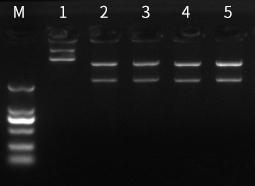
图四:M为Marker;1为阴性;2为常规反应体系酶切结果;3为反应体系内buffer调整用量至4μl;4为反应体系内BspQI酶调整用量至0.8μl ;5为反应体系内调整质粒用量至1.5μg。结果无明显差异,证明酶活性高,可适应反应体系内各组分调整。
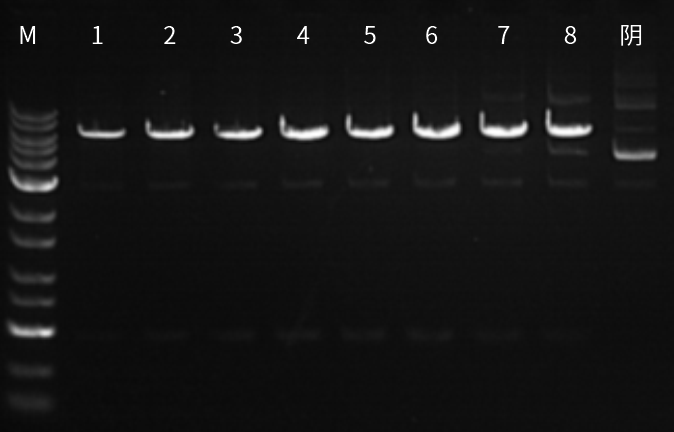
图五:M为Marker;1为500ng底物;2为1μg底物;3为5μg底物;4为7.5μg底物;5为10μg底物;6为15μg底物;7为30μg底物;8为45μg底物;常规反应体系内,近岸蛋白XbaI可以完全酶切15μg底物,证明酶活性高,反应底物可根据具体切割质粒类型灵活调整。
Buffer兼容性好
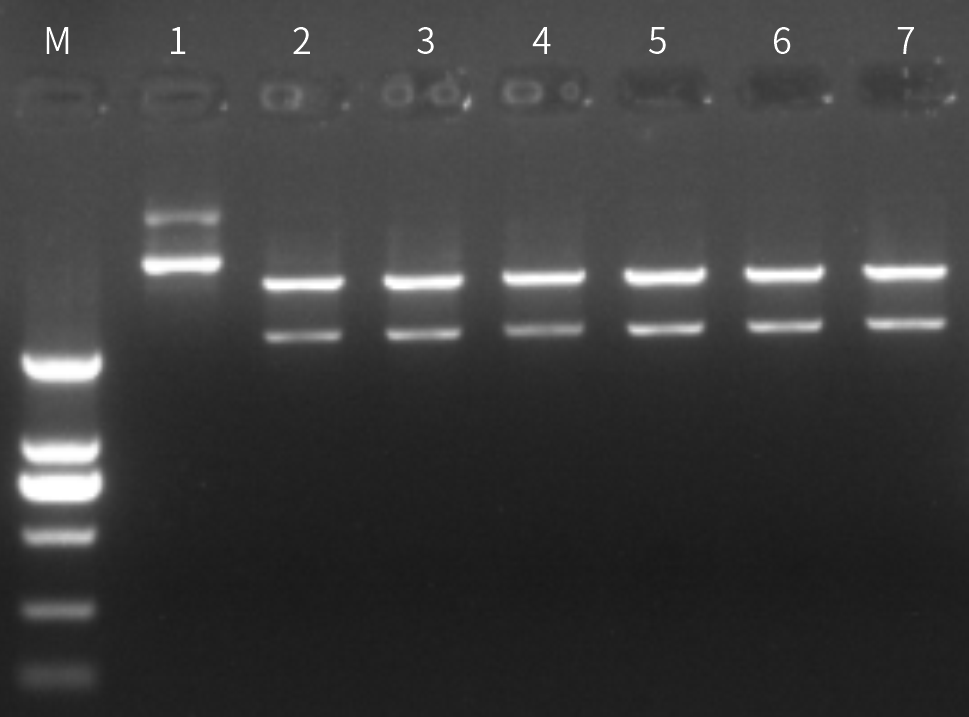
图六:M为Marker;1为阴性;2为近岸蛋白BspQI及对应反应Buffer体系;3为N品牌BspQI及对应反应Buffer体系;4为近岸蛋白BspQI与Buffer1反应体系;5为近岸蛋白BspQI与Buffer2反应体系;6为近岸蛋白BspQI与Buffer3反应体系;7为近岸蛋白BspQI与Buffer4反应体系。结果无明显差异,证明近岸蛋白BspQI适配市面上常见酶切反应Buffer,兼容性好。
热稳定性好
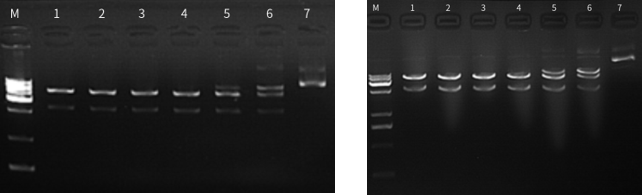
图七:左图为37℃放置0天,右图为37℃放置7天;泳道1为1ul酶用量,泳道2-6为2倍酶活梯度稀释,泳道7为阴性,结果显示BspQI酶活无明显变化,证明其热稳定性强。
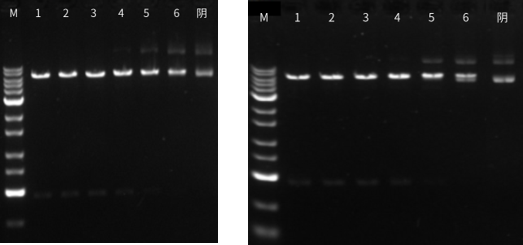
图八:左图为37℃放置0天,右图为37℃放置7天;泳道1为1ul酶用量,泳道2-6为2倍酶活梯度稀释,结果显示XbaI酶活无明显变化,证明其热稳定性强。
过夜酶切及甘油浓度变化,无星号活性
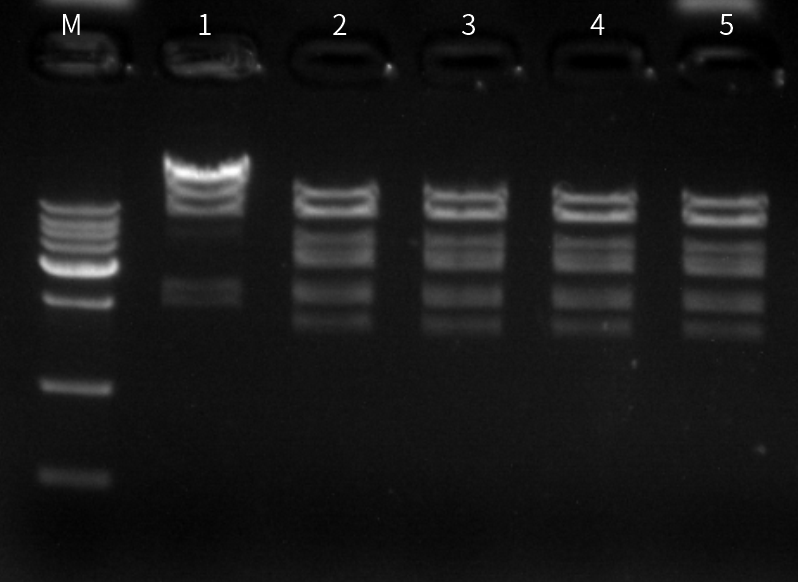
图九:M为Marker;1为阴性;2为N品牌10U BspQI;3为近岸蛋白10U BspQI;4为近岸蛋白20U BspQI;5为近岸蛋白40U BspQI;以lamda-HindIII DNA为底物(底物中含有两个BspQI酶切位点),过夜酶切(16h),结果显示近岸蛋白BspQI星号活性极低。
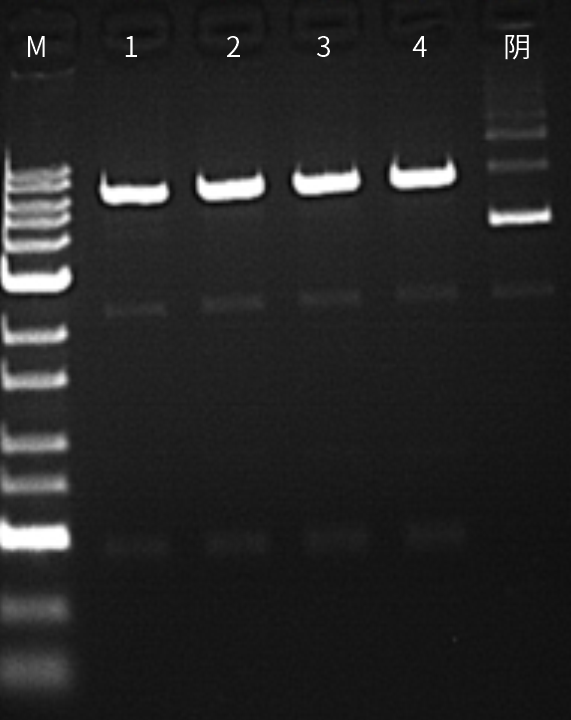
图十:M为Marker;1为甘油浓度1%,反应1小时;2为甘油浓度1%,反应16小时;3为甘油浓度5%反应16小时;4为甘油浓度10%,反应16小时。结果显示近岸蛋白XbaI无星号活性。
欢迎扫码申请!

相关产品:
|
目录号 |
产品名称 |
|
BspQI, GMP Grade |
|
|
GMP-EB057 |
10×BspQI Reaction Buffer, GMP Grade |
|
XbaI, GMP Grade |
|
|
GMP-EB015 |
10×XbaI Reaction Reaction Buffer, GMP Grade |
|
BsaI, GMP Grade |
|
|
10×BsaI Reaction Buffer , GMP Grade |
|
|
T7 RNA Polymerase, GMP Grade |
|
|
10×Transcription Buffer, GMP Grade |
|
|
Vaccinia Capping Enzyme, GMP Grade |
|
|
mRNA Cap 2´-O-Methyltransferase, GMP Grade |
|
|
10×Capping Reaction Buffer, GMP Grade |
|
|
SAM (32mM), GMP Grade |
|
|
E. coli Poly(A) Polymerase, GMP Grade |
|
|
10×Poly(A) Polymerase Buffer, GMP Grade |
|
|
Pyrophosphatase, Inorganic (yeast), GMP Grade |
|
|
RNase Inhibitor, GMP Grade |
|
|
DNase I, GMP Grade |
|
|
T7 RNA Transcription Enzyme Mix, GMP Grade |
|
|
10×Transcription Buffer, GMP Grade |
|
|
ATP, GMP Grade (100mM) |
|
|
ATP, GMP Grade (10mM) |
|
|
GTP, GMP Grade (100mM) |
|
|
GTP, GMP Grade (10mM) |
|
|
CTP, GMP Grade (100mM) |
|
|
UTP, GMP Grade (100mM) |
|
|
N1-Me-Pseudo UTP, GMP Grade |
|
|
Pseudo UTP, GMP Grade |
|
|
eGFP mRNA |
|
|
Luciferase mRNA |
|
|
T7 High Yield RNA Transcription kit |
|
|
Thermostable T7 RNA Polymerase |
|
|
Cap 1 Capping System |
|
|
RNA Clean Beads |
|
|
Lithium Chloride Precipitation Solution |
