截至 2024 年 10 月 31 日,MCE 产品已被 Cell, Nature, Science 等共 3,157 家学术期刊所引用,发表的文献共 47,000+ 篇,其中包括 255 篇 CNS 期刊文献!
2024 年 10 月 MCE 单月收录文章 682 篇,文章影响因子 (IF) 总和高达 4,600+,其中,IF≥20 分的文献共 22 篇 (图 1)。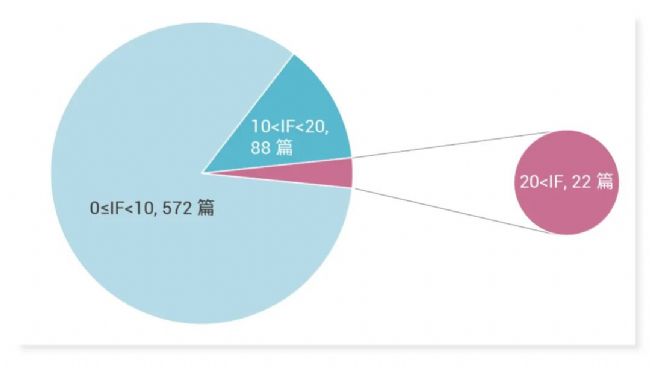
图 1. 2024 年 10 月引用 MCE 产品发表文献的 IF 情况。
【投稿活动】
我们每月收集引用 MCE 产品发表的文献。如果您引用了 MCE 产品并发表科研文章,特邀您投稿参与 2024 MCE 中国生命科学促进奖活动!投稿者将获得 MCE 积分奖励。评比结果公布后,前十位获奖者将获得优秀科研奖励金及专属奖杯、奖状等荣誉~
本期小 M 在本次促进奖 10 月投稿中为大家精选了 4 篇引用 MCE 产品在肿瘤与癌症方向的研究文献,一起来看下吧!
01
Immunity
2024 年 10 月 8 日,中国科学技术大学免疫研究所的研究团队在 Immunity (IF=25.5) 上发表了题为“Interleukin-34-orchestrated tumor-associated macrophage reprogramming is required for tumor immune escape driven by p53 inactivation”的研究成果[1]。
作为癌症中最常见的基因突变之一,超过一半的人类癌症存在 p53 突变。然而,p53 如何调节免疫以创造免疫逃逸仍然难以捉摸。
研究人员发现,在 p53 失活的肝癌中,癌症干细胞(CSCs)建立了一个由 IL-34 调节的生态位,以促进肿瘤的发生。机制上,研究人员发现 IL-34 是 p53 转录抑制的基因,p53 缺失导致 CSCs 分泌 IL-34。IL-34 诱导 CD36 介导的脂肪酸氧化代谢的升高,驱动泡沫状肿瘤相关巨噬细胞(TAMs)向 M2 样极化。这些由 IL-34 调节的 TAMs 抑制 CD8+ T 细胞介导的抗肿瘤免疫反应,促进免疫逃逸。阻断 IL-34-CD36 轴引发抗肿瘤免疫反应,并与抗 PD-1 免疫疗法协同作用,导致完全缓解。研究人员的发现揭示了 p53 调节肿瘤免疫微环境的潜在机制,为具有 p53 失活的癌症的免疫疗法提供了潜在靶点。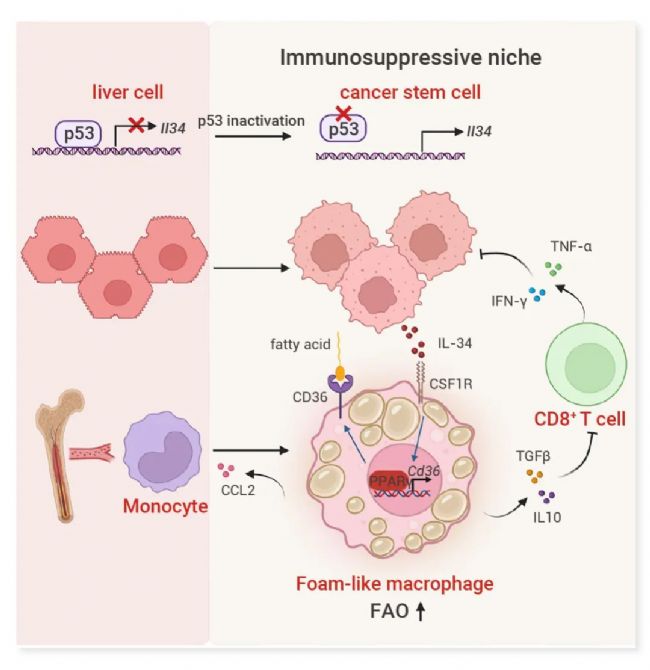
图 2. p53 失活导致 CSCs 分泌 IL-34,而 IL-34-CD36 轴调控的 TAMs 通过抑制 T 细胞介导的抗肿瘤免疫来促进肿瘤免疫逃逸[1]。
研究发现:
1) p53 功能丧失导致癌干细胞分泌 IL-34;
2) IL-34-CD36 轴驱动 Trp53-/- 肿瘤中泡沫状巨噬细胞向 M2 极化;
3) IL-34 调控的 TAMs 抑制 T 细胞介导的免疫反应;
4) 阻断 IL-34 信号通路和 PD-1 可导致 Trp53-/- 肿瘤完全缓解。
引用 MCE 产品:

02
Adv Sci (Weinh)
2024 年 8 月 9 日,厦门大学附属第一医院的研究团队在期刊 Adv Sci (Weinh) (IF=14.3) 上发表了题为 “Methuosis Inducer SGI-1027 Cooperates with Everolimus to Promote Apoptosis and Pyroptosis by Triggering Lysosomal Membrane Permeability in Renal Cancer” 的研究成果。
mTOR 抑制剂 Everolimus 已被批准作为肾细胞癌 (RCC) 的序贯或二线治疗。然而,耐药的发展限制了其临床应用。该研究旨在解决 Everolimus 耐药的挑战,并为晚期 RCC 的治疗提供新的见解。
该研究首次发现并证明了 DNA 甲基转移酶 1 (DNMT1) 抑制剂 SGI‐1027 在诱导细胞空泡化和巨泡式死亡中的细胞毒性。此外,SGI‐1027 与 Everolimus 具有协同作用,它们联合抑制肾癌细胞的生长、迁移和侵袭。在机制上,观察到由溶酶体膜通透性 (LMP) 引发的细胞凋亡和 GSDME 依赖性焦亡。肾癌细胞中 GSDME 表达上调,溶酶体活性升高,为两种药物联合治疗肾癌提供了治疗窗口期。联合治疗显示出有效的抗肿瘤活性,并且在皮下肿瘤模型中具有良好的耐受性。
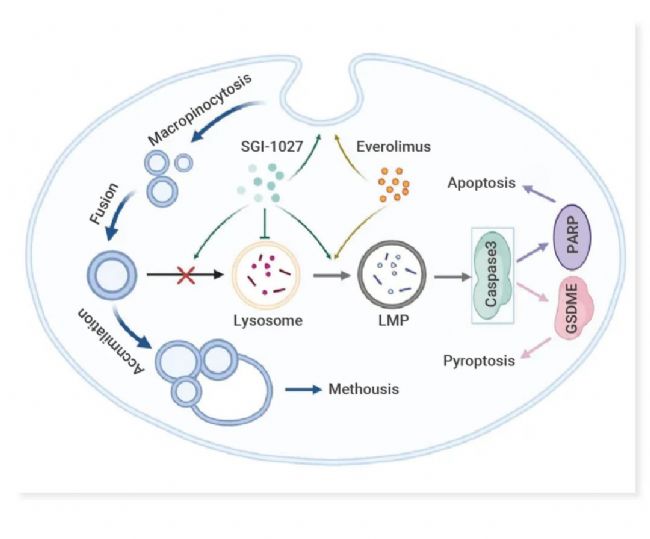
图 3. SGI-1027 通过巨噬细胞作用诱导空泡形成,抑制空泡与溶酶体的融合[2]。
Everolimus 增强巨噬细胞增多过程,与 SGI-1027 协同诱导 LMP,导致细胞凋亡和 GSDME 依赖性焦亡。
研究发现:
1) SGI-1027 通过巨噬细胞作用诱导肾癌细胞形成液泡;
2) SGI-1027 诱导的肾癌细胞毒性与甲氧嘧啶中毒有关;
3) SGI-1027 联合 Everolimus 抑制肾癌细胞增殖;
4) SGI-1027 联合 Everolimus 诱导细胞凋亡和 GSDME 依赖性焦亡;
5) SGI-1027 和 Everolimus 协同抑制肾癌细胞集落形成、迁移和侵袭;
6) RNA 测序分析揭示了协同效应与溶酶体之间的关联;
7) SGI-1027 联合 Everolimus 诱导肾癌细胞溶酶体膜通透性;
8) 靶向 LMP 和 GSDME 依赖性焦亡证明了 RCC 治疗的可行性;
9) SGI-1027 联合 Everolimus 在体内发挥协同抗肿瘤作用。
引用 MCE 产品:

03
Cell Death Dis
2024 年 10 月 1 日,华中科技大学附属同济医院的研究团队在 Cell Death Dis (IF=8.1) 上发表 “GPR56 facilitates hepatocellular carcinoma metastasis by promoting the TGF-β signaling pathway” 的研究成果。
肝细胞癌 (HCC) 的转移严重威胁着患者的生存。GPR56 在恶性肿瘤研究中受到广泛关注,在细胞表面信号传递中起着至关重要的作用。尽管如此,其在 HCC 中的确切功能仍不清楚。
该研究显示,人类 HCC 病例中 GPR56 表达水平显著升高,其与不良预后密切相关。GPR56 通过与 TGFBR1 相互作用调控 TGF-β 通路,促进 HCC 转移。同时,GPR56 受 TGF-β 信号的典型级联调控,形成正反馈回路。此外,TGFBR1 抑制剂 Galunisertib (GAL) 与 GPR56 抑制剂 Dihydromunduletone (DHM) 联合应用可显著抑制 HCC 转移。干预这一通路可为 GPR56 介导的 HCC 转移提供一种有希望的治疗方法。
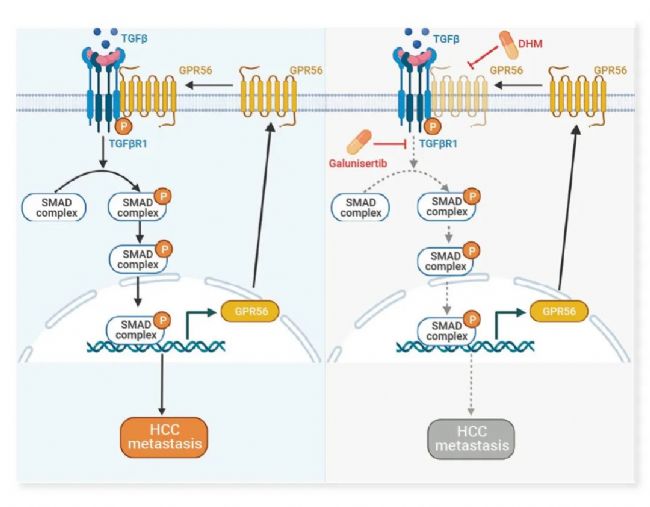
图 4. 肝癌中 TGF-β 通路的 GPR56 正反馈回路示意图[3]。
研究发现:
1) GPR56 高表达与 HCC 患者的临床预后相关;
2) GPR56 在体内外均可促进肝癌的转移;
3) GPR56 通过 TGFBR1 促进肝癌转移;
4) TGF-β1/SMAD3 通路调控 GPR56 转录;
5) TGFBR1 抑制剂 GAL 和 gpr56 特异性小分子抑制剂 DHM 的联合治疗显著降低了 gpr56 驱动的肝癌转移;
6) GPR56 与 SMAD3/p-SMAD3 在 HCC 中具有相似的表达特征。
引用 MCE 产品:

04
J Adv Res
2024 年 9 月 29 日,无锡市人民医院的研究团队在期刊 J Adv Res (IF=11.4)发表题为 “Salidroside sensitizes Triple-negative breast cancer to ferroptosis by SCD1-mediated lipogenesis and NCOA4-mediated ferritinophagy” 的研究成果。
三阴性乳腺癌 (TNBC) 是导致女性乳腺癌死亡的主要原因。文献已证实红景天苷 (Salidroside, Sal) 治疗 TNBC 的益处。然而,基于 Sal 对 TNBC 的潜在治疗靶点及机制的研究仍较为有限。
本研究整合了网络药理学、生物信息学和机器学习算法策略来研究 Sal 在 TNBC 中的作用、潜在靶点和机制。选择 MDA-MB-231 细胞和荷瘤裸鼠进行体内外实验。采用 CCK-8 法、LDH 法、Calcein-AM/PI 染色法检测细胞活力和细胞毒性。利用谷胱甘肽、谷胱甘肽过氧化物酶、丙二醛 (MDA)、C11-BODIPY 581/591 探针和 FerroOrange 染料探究抗氧化防御、脂质过氧化和铁代谢。谷胱甘肽过氧化物酶 4 (GPX4) 或硬脂酰辅酶 a 去饱和酶 1 (SCD1) 过表达或核受体共激活因子 4 (NCOA4) 缺乏被用来证明 Sal 对 TNBC 的作用机制。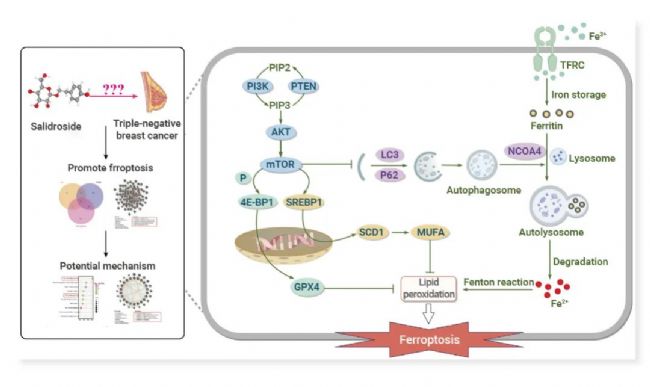
图 5. Salidroside 通过 SCD1 介导的脂肪生成和 NCOA4 介导的铁死亡使三阴性乳腺癌对铁死亡敏感[4]。
结果表明在 Sal 和 TNBC 中鉴定出 22 个铁死亡相关基因,揭示 Sal 作用于 TNBC 的潜在机制与铁死亡相关。功能富集分析发现这些基因主要参与 mTOR、PI3K/AKT、自噬信号通路。在体外,Sal 通过上调细胞内 Fe2+ 和脂质过氧化来调控铁死亡,从而抑制 TNBC 细胞增殖。机制上,Sal 通过抑制 PI3K/AKT/mTOR 轴,从而抑制 SCD1 介导的单不饱和脂肪酸的脂质生成,从而诱导脂质过氧化,以及促进 NCOA4 介导的铁死亡,从而增加细胞内 Fe2+ 含量,使三阴性乳腺癌细胞对铁死亡敏感。
研究发现:
1) 红景天苷 (Salidroside, Sal) 通过诱导铁死亡抑制 TNBC,与细胞内 Fe2+ 增加和脂质过氧化有关;
2) Sal 通过促进 NCOA4 介导的铁死亡增加细胞内 Fe2+ 水平;
3) Sal 通过抑制 SCD1 介导的单不饱和脂肪酸脂质生成诱导脂质过氧化反应;
4) Sal 通过 PI3K/AKT/mTOR 通路调节铁死亡和脂肪生成;
5) Sal 可能成为治疗 TNBC 的有效药物。
引用 MCE 产品:

MCE 中国 2024 第九届生命科学研究促进奖
活动时间:2024 年 1 月 1 日 - 2024 年 12 月 31 日
发表科研文章引用 MCE 产品,投稿 2024 生命科学研究促进奖,
可获得丰厚投稿奖励喔~
点击下方卡片了解详情
参考文献:
[1] Nian, Zhigang et al. “Interleukin-34-orchestrated tumor-associated macrophage reprogramming is required for tumor immune escape driven by p53 inactivation.” Immunity vol. 57,10 (2024): 2344-2361.e7.
[2] Luo, Yu et al. “Methuosis Inducer SGI-1027 Cooperates with Everolimus to Promote Apoptosis and Pyroptosis by Triggering Lysosomal Membrane Permeability in Renal Cancer.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 11,38 (2024): e2404693.
[3] Feng, Rui et al. “Generation of Anti-Mastitis Gene-Edited Dairy Goats with Enhancing Lysozyme Expression by Inflammatory Regulatory Sequence using ISDra2-TnpB System.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 11,38 (2024): e2404408.
[4] Huang, Guiqin et al. “Salidroside sensitizes Triple-negative breast cancer to ferroptosis by SCD1-mediated lipogenesis and NCOA4-mediated ferritinophagy.” Journal of advanced research, S2090-1232(24)00429-6. 29 Sep. 2024.





























