听力丧失是最常见的感官障碍之一,影响着很多人。根据世卫组织公布的《世界听力报告》,现有超15亿人患有不同程度的听力损失,到2050年,患听力损失的人数将近25亿。据统计,大约50%的先天性听力损失与遗传因素有关,目前临床上的治疗方案主要为佩戴助听器或植入人工耳蜗,但此类方法没有从根本上治愈听力损伤。因此,治疗听力损失需要更好的替代疗法。随着基因治疗的蓬勃发展,基于病毒载体的基因疗法成为治疗遗传性听力损失的新热门赛道。
重组腺相关病毒载体(recombinant Adeno-associated virus, rAAV)具有血清型种类多样、免疫原性低、长期稳定表达基因、宿主范围广等优势,在基因功能研究和基因治疗递送载体中占据主导地位。
上篇文章我们给大家分享了靶向耳科的AAV血清型(【on-target】AAV感染耳组织 | 血清型·启动子·注射用量 | 一篇就GO了!),这次小编再次给大家分享一个全新的安全载体—AAV-ie-K558R,其可以高效转导新生小鼠耳蜗毛细胞(Hair Cells, HCs)和支持细胞(Supporting cells, SCs),显示了在治疗由毛细胞死亡或基因突变引起的听力损失方面的临床潜力。相关研究成果由上海科技大学钟桂生、上海交通大学吴皓及东南大学柴人杰合作于2022年4月22日,发表在Signal Transduction and Targeted Therapy杂志,标题为“AAV-ie-K558R mediated cochlear gene therapy and hair cell regeneration”。

内耳包含三种主要功能细胞:毛细胞(Hair Cells, HCs)、支持细胞(Supporting cells, SCs)和螺旋神经节(Spiral Ganglion Neurons, SGNs),其中HCs又包括内毛细胞(Inner hair cells, IHCs)和外毛细胞(Outer hair cells, OHCs),OHCs负责将声音放大;IHCs负责将液体波动转化为电信号,并通过听觉神经传递到听觉脑干,再到听觉皮层。
内耳耳蜗HCs和SCs对听力至关重要,感音神经性听力损失可能由HCs和SCs的基因突变引起,此外,在非遗传情况,如噪音、耳毒性药物或衰老,也可通过损害HCs引起耳聋。在任何一种情况下,这些损害对于没有再生能力的耳蜗细胞的哺乳动物都是不可逆转的。目前的研究认为,SCs具有转分化为HC样细胞的潜力,因此,HC再生被认为是非遗传应激引起的获得性耳聋的潜在治疗方法。
该团队早在2019年全新筛选发现的AAV-ie,可以更高效感染HCs和多种类型SCs。此外,AAV-ie携带Atoh1(耳蜗毛细胞再生因子)感染内耳后,实现了内毛细胞再生。但是AAV-ie在耳蜗基底区的转导效率有待提高。
结果
1 AAV-ie-K558R是一种安全的高效靶向HCs和SCs的载体
首先,该团队基于之前筛选发现的AAV血清型—AAV-ie(高效转导啮齿类和人的HCs和多种类型SCs,但在耳蜗基底区的转导效率较低)基础上做进一步筛选,发现AAV-ie-K558R对耳蜗基底OHCs和IHCs具有较高的转导率。和AAV-ie相比,AAV-ie-K558R对耳蜗中部OHCs的转录及耳蜗基底SCs的转导均有所提高(图1a-f)。这提示了AAV-ie-K558R可以高效靶向耳蜗和内耳椭圆囊中的不同细胞类型。
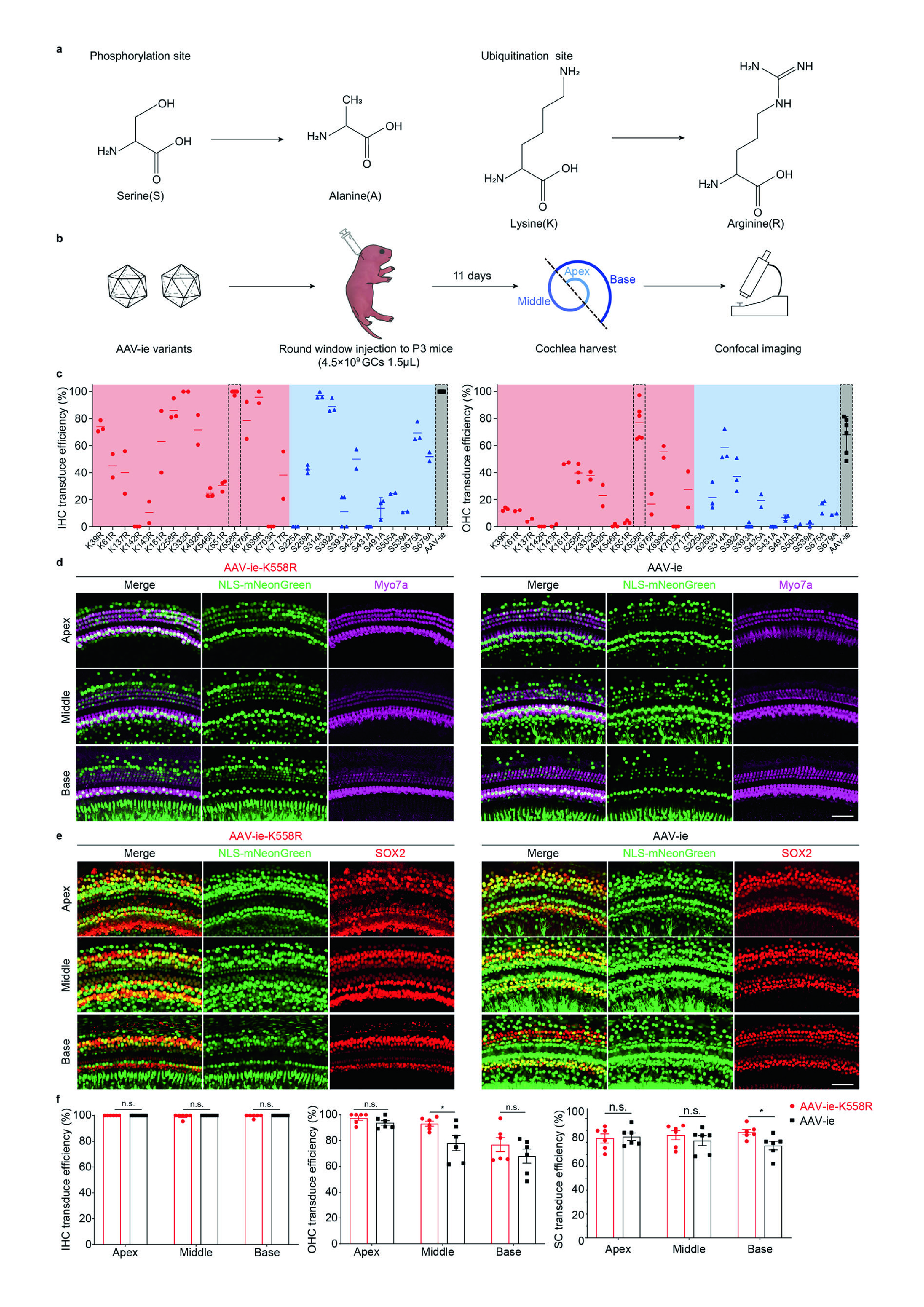
图1 AAV-ie-K558R转导效率提高
进一步,研究团队通过电镜、ABR测试、DPOAE测试及行为学等手段验证了AAV-ie-K558R的安全性,发现P3小鼠圆窗膜(round window membrane, RWM)注射AAV-ie-K558R后,毛细胞形态无明显变化,听觉功能及前庭功能和对照组相比无明显差异(图2)。这些结果提示了,AAV-ie-K558R作为一种安全的高效靶向HCs和SCs的载体,在介导听觉系统疾病的基因疗法中的巨大潜力。
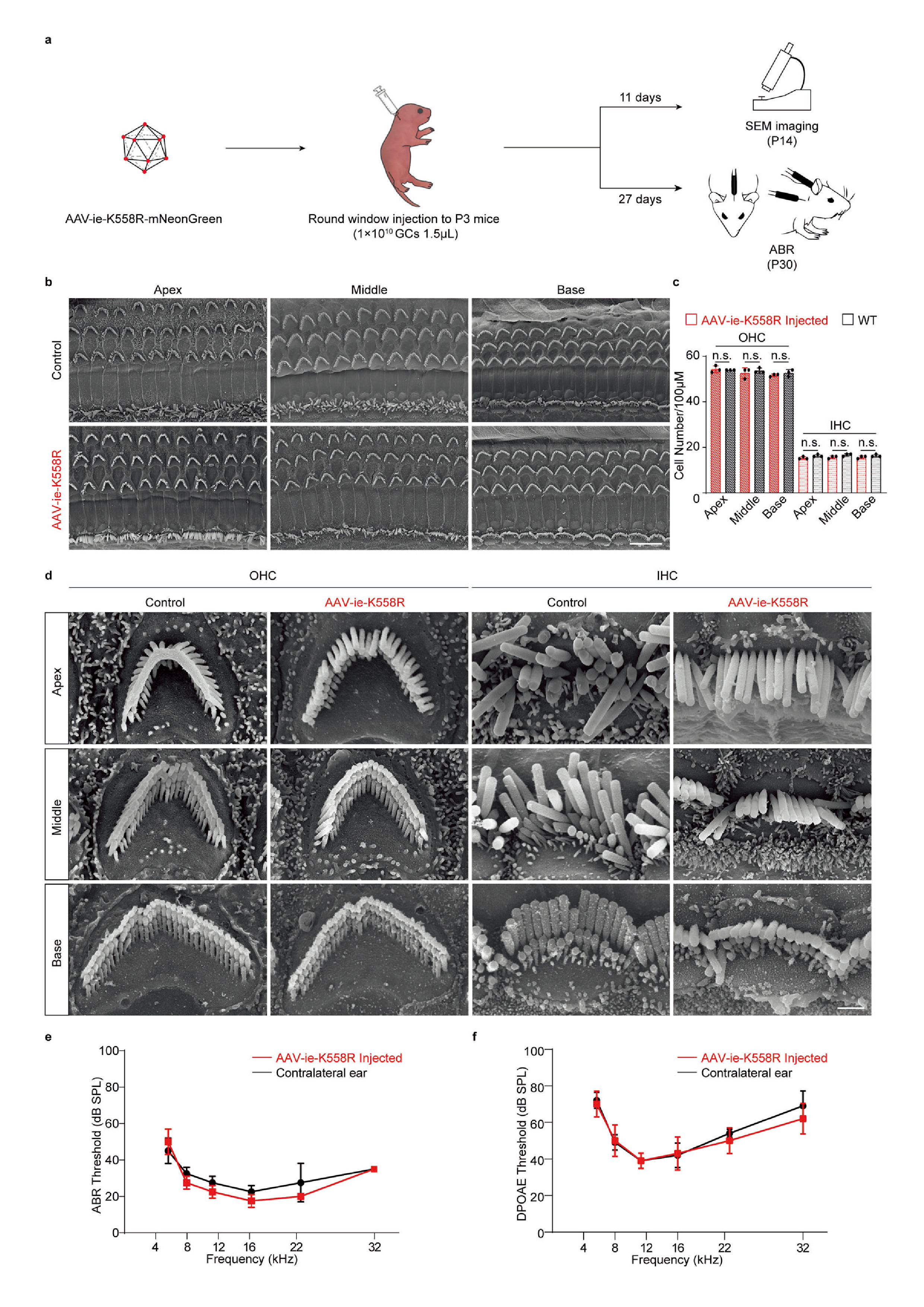
图2 AAV-ie-K558R是一种安全载体
和元生物已获得AAV-ie血清型的官方授权,得到**持有者官方认证的AAV-ie系列产品将全力保障您的内耳听觉毛细胞基因递送之旅,欢迎咨询了解!
2 AAV-ie-K558R在纠正功能失调的基因突变或用于 HC 样再生中的潜力
Prestin(马达蛋白)是一种特异性定位于外毛细胞的关键分子,其能驱动耳蜗外毛细胞的电能动性,产生耳蜗的放大器作用,Prestin蛋白的缺失或基因的突变会导致听力功能严重受损。因此,研究团队借助Prestin KO小鼠测试AAV-ie-K558R在治疗由内耳毛细胞基因功能障碍引发的听力损伤中的潜力。将AAV-ie-K558R-Prestin通过圆窗膜注射P2 Prestin KO小鼠。结果发现,可以部分恢复 Prestin KO 小鼠的听力损失(图3)。

图3 AAV-ie-K558R-Prestin恢复Prestin KO小鼠的听觉功能
毛细胞再生可能有助于恢复由衰老、噪音或耳毒性药物引起的听力损失。耳蜗毛细胞再生因子Atoh1被证明能够将SCs转分化为HCs,基于此,研究者进一步探究AAV-ie-K558R在HC再生中的潜力。借助AAV-ie-K558R携带Atoh1注射新生小鼠(P3)耳蜗中,在P14时发现,AAV-ie-K558R-Atoh1组小鼠大上皮嵴(greater epithelial ridge,GER区)观察到大量的新HCs(表达Myo7a),且一些新HC样细胞也表达Sox2,提示了这些新再生的细胞可能处于发育的不同阶段(图4a,b)。通过电镜观察新再生细胞的形态发现,IHC区域下方的HC样细胞中生长出毛发束(图4c)。该团队早期研究发现AAV-ie-Atoh1也可以诱导HC样细胞再生,而AAV-ie-K558R-Atoh1可以诱导耳蜗GER区的HC样细胞再生,且新生成的HC样细胞形态不同,有些细胞具有动纤毛(代表着耳蜗毛细胞发育较为成熟阶段)。总之,这些结果提示了AAV-ie-K558R 可以通过传递Atoh1强烈诱导耳蜗中的 HC 样细胞再生。

图4 AAV-ie-K558R-Atoh1诱导耳蜗中的 HC 样细胞再生
结论
该团队通过对AAV衣壳进行突变筛选,在AAV-ie的基础上筛选出新的AAV-ie-K558R载体,可以高效感染耳蜗HCs和SCs,并且通过携带不同基因,恢复了由基因突变导致的听力损伤,以及诱导HC样细胞再生。证明了AAV-ie-K558R在治疗由毛细胞死亡或基因突变引起的听力损失方面的临床潜力。
和元生物已获得AAV-ie血清型的官方授权,得到**持有者官方认证的AAV-ie系列产品将全力保障您的内耳听觉毛细胞基因递送之旅,欢迎咨询了解!
