作者:郑旺博士
胶质母细胞瘤(GBM)是世界卫生组织四级脑部恶性脑肿瘤,是最致命的人类癌症之一,多呈浸润性成长,外科手术很难做到真正的完全切除,而放射治疗可有效杀灭或者抑制残余的肿瘤细胞,因此目前临床上将术后联合放化疗作为神经胶质瘤的标准治疗方案。然而,大量报道证实GBM对电离辐射并不敏感,这也是限制患者生存率的最重要因素之一。就恶性肿瘤而言,自噬介导的细胞内分解代谢作为肿瘤对辅助放射治疗等治疗反应的促进生存过程。因此,自噬被认为是一种适应性机制,导致肿瘤获得对治疗的抗性。因而,深入开展GBM放疗耐受的调控基因及主要机制的研究,不仅可以从细胞及分子水平系统揭示辐射耐受的深层机理,更能通过靶向调控这些关键的基因或蛋白,提高临床神经胶质瘤患者放疗的疗效,有效改善患者预后。2022年8月1日,复旦大学放射医学研究所邵春林教授团队在《Autophagy》(2022 IF:13.391)上发表题为“SDC1-dependent TGM2 determines radiosensitivity in glioblastoma by coordinating EPG5-mediated fusion of autophagosomes with lysosomes”的研究论文,该研究揭示了胶质母细胞瘤中转谷氨酰胺酶TGM2通过多配体聚糖SDC1依赖的方式转运至溶酶体,促进束缚因子EPG5介导的自噬体-溶酶体融合,最终增强肿瘤的辐射抵抗,为胶质母细胞瘤放疗提供新的潜在增敏靶点。吉凯基因提供了本研究中的TMT蛋白质组学分析以及质粒构建服务。

1. 自噬活动在辐射抗性的GBM细胞中增强
研究者通过多阶段的X射线处理GBM U251细胞系获得了辐射抗性的细胞系U251R,但仍低于T98G的辐射抗性。随后,研究者检测了辐射抗性细胞中的自噬活动。结果表明,在辐射抗性的GBM细胞系中,辐射诱导的自噬溶酶体形成被显著增强,而抑制自噬则增强了GBM细胞对放射的敏感性。这些结果表明,GBM细胞的辐射抗性与自噬活动增强有关。
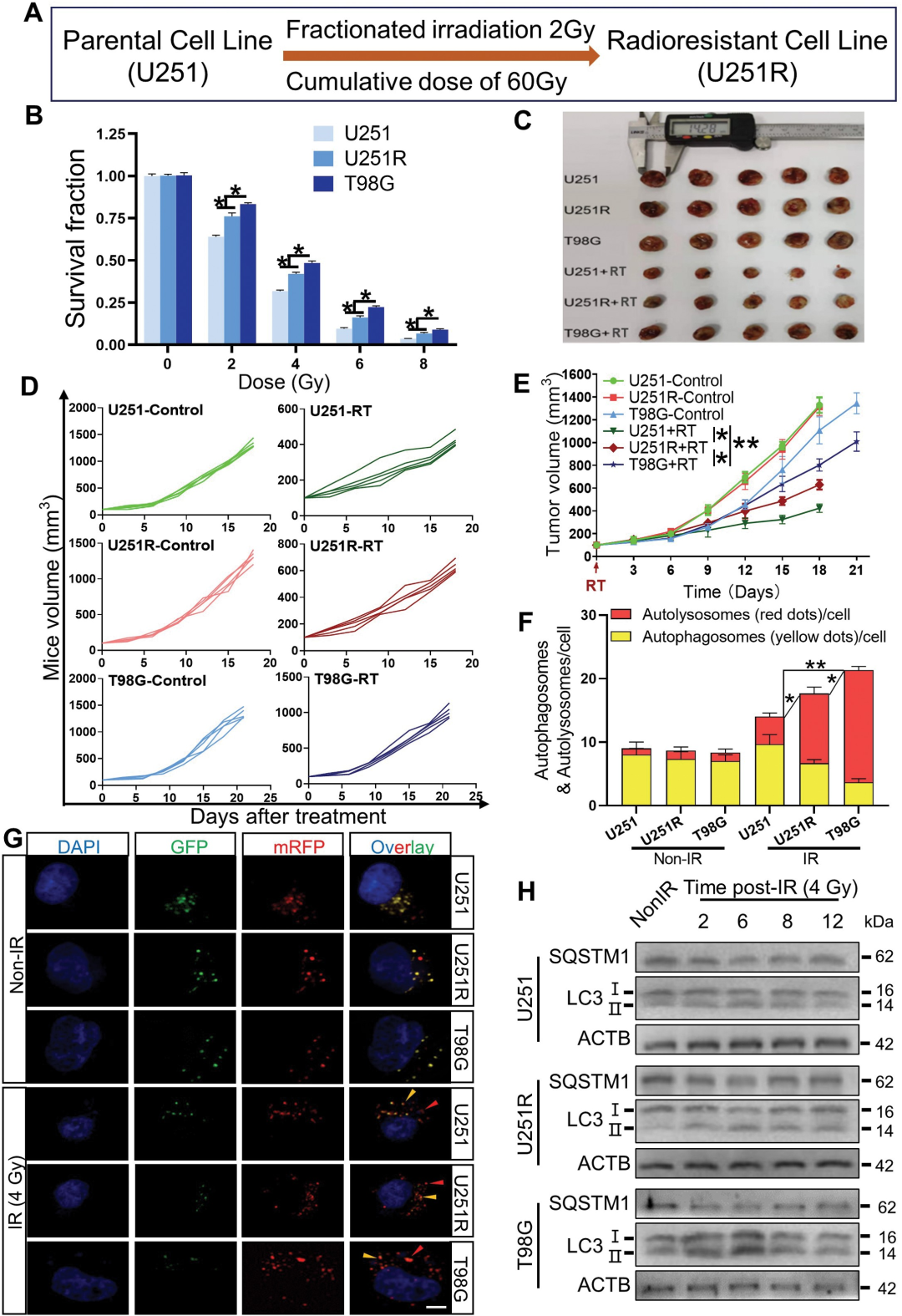
2. 蛋白质组学发现辐射抗性细胞中的差异蛋白
为了寻找在参与GBM辐射抗性的关键基因,研究者使用TMT蛋白质组学对U251、U251R,和T98G细胞进行蛋白表达谱检测(蛋白质组学技术服务由吉凯基因提供),并通过U251R比U251、 T98G比U251 和 T98G比U251R寻找差异蛋白。研究者重点关注了可能成为治疗靶点的上调蛋白。三个比较共有的上调蛋白有17个,在这其中,SDC1和TGM2同时在GBM患者中高表达,且这两个基因与差的预后相关。免疫组化染色也表明,SDC1和TGM2在对放疗不敏感的GBM组织中上调。因此,研究者将重点放到了这两个基因上。蛋白-蛋白相互作用分析表明这两个蛋白不直接关联,而临床相关的分析上,这两个蛋白的存在共表达关系。综合以上分析表明,SDC1和TGM2在辐射抗性的GBM细胞和组织中的高表达与肿瘤发展和差的预后有关。
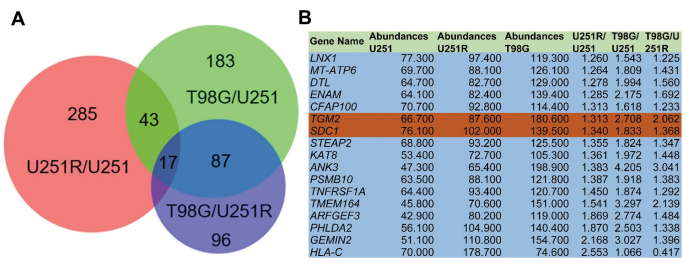
3. SDC1和TGM2通过促进自噬体的成熟增强细胞的辐射抗性及自噬
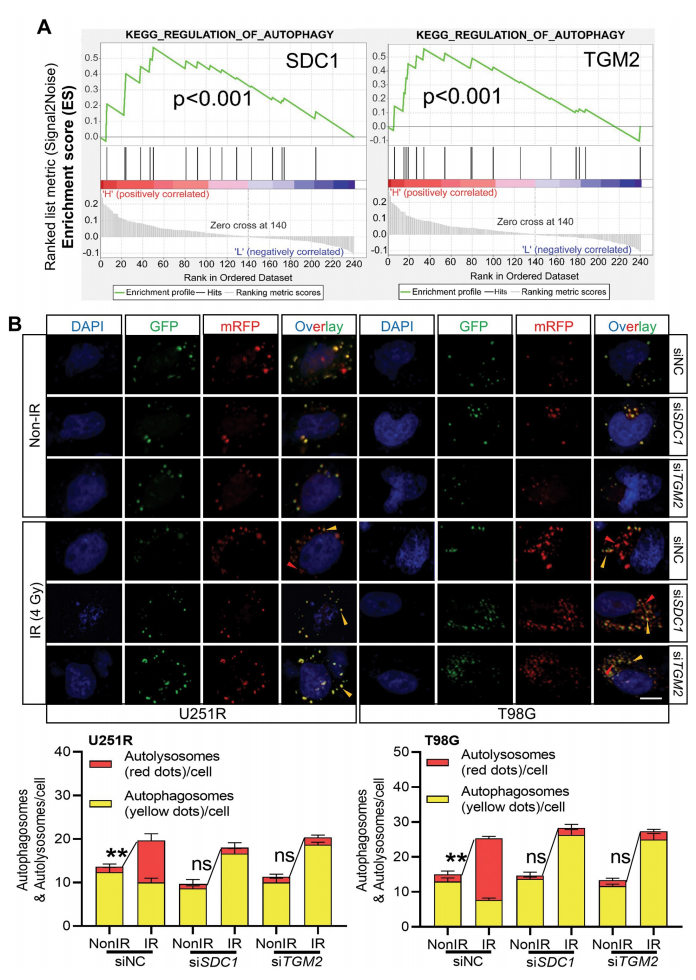
进一步,研究者检测了SDC1和TGM2在转录和蛋白水平的表达,并发现它们在U251、U251R和T98G细胞中有序增加,即与辐射抗性呈正相关。当在细胞中干扰SDC1和TGM2的表达后,暴露于X射线的U251R和T98G细胞的存活显著降低,这表明SDC1和TGM2有助于GBM细胞的辐射抗性。
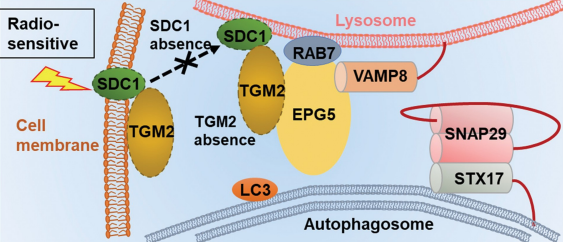
随后,研究者检测了SDC1和TGM2调控的辐射敏感性和自噬活性的关系。KEGG富集分析显示,SDC1和TGM2均参与自噬调控的途径。而当GBM细胞中的SDC1或TGM2被干扰时(siSDC1和siTGM2),在辐射后,细胞中的自噬体形成减少、LC3 II:I升高、SQSTM1降解减少,这表明自噬体成熟过程被封闭。重要的是,研究者发现SDC1和TGM2的互作促进了GBM细胞中自噬体和溶酶体的融合过程。
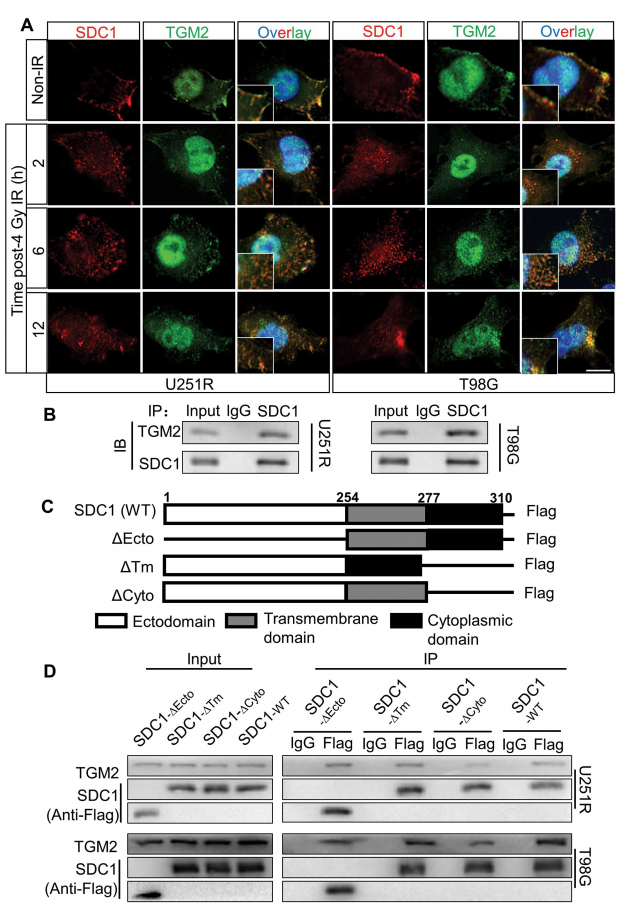
4. SDC1启动辐射后TGM2从细胞膜到溶酶体的转位
为了进一步理解SDC1和TGM2是如何诱导自噬体的成熟,研究者检测了GBM细胞中SDC1和TGM2的亚细胞定位。免疫荧光染色表明,在未辐射下,SDC1蛋白主要定位在细胞膜上,而TGM2一部分与SDC1定位在细胞膜上,一部分则定位在细胞核内。在4Gy辐射12h内,尤其是6h时,细胞膜上的SDC1和TGM2显著减少,而细胞浆中的SDC1和TGM2则增加。研究者排除了细胞浆中TGM2来自于细胞核的可能性。随后,研究者探究了是SDC1、TGM2还是其他蛋白启动了这种细胞浆转运。结果表明,抑制大型胞饮作用(macropinocytosis)或干扰SDC1均可以减弱辐射后SDC1和TGM2在细胞浆中的增加。进一步地,研究者通过CO-IP实验明确了SDC1和TGM2的强结合作用。随后,研究者通过表达不同结构域缺失的SDC1(质粒产品由吉凯基因提供),明确了在GBM细胞中,SDC1通过它的胞浆结构域转运TGM2至溶酶体,参与辐射诱导的自噬体成熟。
5. TGM2-LC3相互作用促进自噬体对EPG5的捕获以及含STX17的QabcR SNARE复合体的组装
研究者进一步检测了SDC1和TGM2直接结合LC3的可能性。TGM2上有两个潜在的结合LC3的结构域——WLTL和FILL,而SDC1没有。研究表明,TGM2利用其自身两个LC3相互作用区与自噬体LC3结合,促进定位于溶酶体的束缚因子EPG5与LC3结合,进而捕获自噬体并招募装配QabcR SNARE复合体(VAMP8-STX17-SNAP29),最终自噬溶酶体形成,肿瘤辐射抵抗增加。
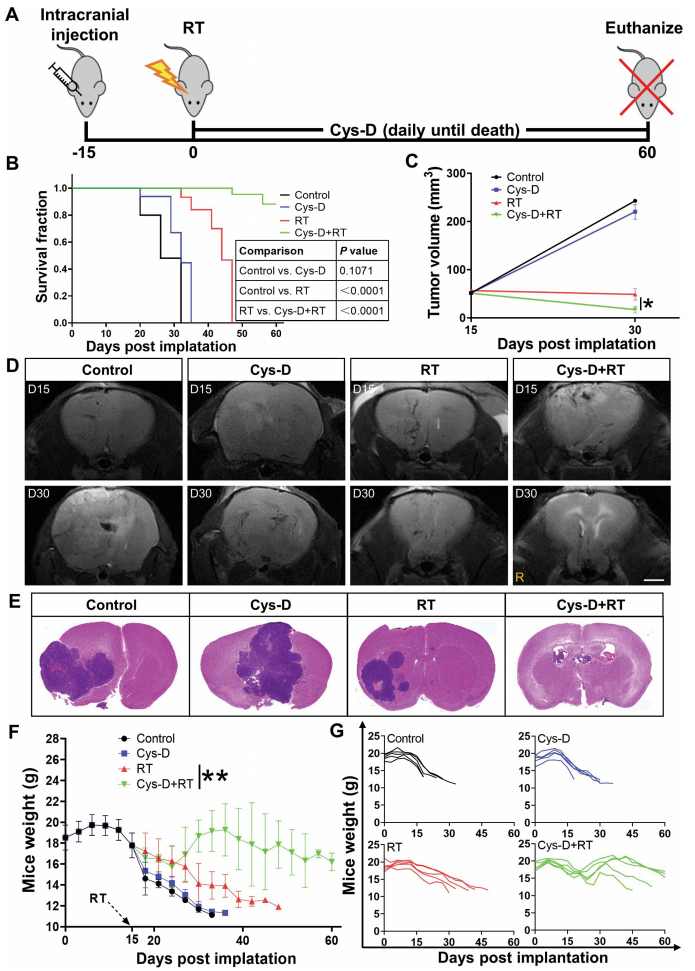
6. 放疗(RT)和Cys-D联用可以改善GBM荷瘤小鼠的生存和病理响应
在探究完SDC1和TGM2促进GBM辐射抗性的机制后,研究者想知道一个TGM2抑制剂cystamine dihydrochloride(Cys-D)对GBM辐射敏感性的作用。Cys-D处理可以有效抑制TGM2的表达、显著提升U251R和T98G细胞的辐射敏感性。研究者构建了U251R细胞的异种原位移植瘤小鼠模型,并发现单用Cys-D治疗可以将荷瘤小鼠的中位生存时间从26天延长至32(无统计学显著性),而单独使用放射治疗(RT)可以将中位生存时间延长至44天。联合使用Cys-D和RT后,60%的小鼠在60天时仍然存活。与对照组和单一治疗组相比,联合治疗组的小鼠在15天和30天时的肿瘤体积显著减小,存活60天的联合治疗小鼠的脑部肿瘤得到有效清除。此外,联合治疗的小鼠体重增加,而对照组及单一治疗组的小鼠随着肿瘤的进展出现营养不良和恶病质。以上结果表明,TGM2抑制剂和放射治疗联合使用可作为GBM的潜在治疗选择。
本研究细胞蛋白组学(吉凯基因提供)和临床病理切片分析,发现SDC1与TGM2是两个协同促进胶质母细胞瘤辐射抵抗的生物标记物,抑制SDC1与TGM2蛋白表达水平显著的增强了GBM细胞的辐射敏感性。进一步研究发现,细胞自噬水平在GBM的辐射抵抗发生发展中发挥了重要作用,而SDC1与TGM2可以通过调控自噬进程中关键“清道夫”—自噬溶酶体的形成,介导细胞的辐射抵抗。机制研究表明,肿瘤受辐射后,细胞表面的SDC1发生内化,携带TGM2转运至溶酶体,TGM2利用其自身两个LC3相互作用区与自噬体LC3结合,促进定位于溶酶体的束缚因子EPG5与LC3结合,进而捕获自噬体并招募装配QabcR SNARE复合体(VAMP8-STX17-SNAP29),最终自噬溶酶体形成,肿瘤辐射抵抗增加。临床转化研究方面,该团队发现给予口服TGM2抑制剂胱胺二/盐/酸/盐可显著提高原位移植肿瘤的放疗缓解效果,有效延长小鼠生存期。
吉凯助力
吉凯基因提供了本研究中的TMT蛋白质组学分析以及质粒构建服务。


作者简介
复旦大学放射医学研究所邵春林教授为该论文的首要通讯作者,副研究员张江虹和潘燕为共同通讯作者,博士研究生郑旺和陈倩萍为论文的共同第一作者。该研究获得了国家自然基金、上海市科技计划项目等的资助。

左三:邵春林教授;右三:郑旺博士;左二:陈倩萍博士

邵春林教授课题组
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务
