体内细胞命运转化是一种潜在的再生疗法,可以用于损伤和疾病治疗。之前的研究认为通过异位表达或敲低特定因子,可以将星形胶质细胞转化为功能性神经元。然而,通过严格的谱系追踪实验证明,先前认为是由星形胶质细胞转化而来的神经元,实际上是由内源性神经元转化而来。通过AAV介导NEUROD1和报告基因的共表达,可以有效地诱导报告基因标记的神经元,但这些神经元无法通过谱系追踪追溯到星形胶质细胞。相反,逆行标记方法表明内源性神经元是这些表达AAV标记神经元的来源。这些结果强调了谱系追踪策略在体内细胞命运转化研究中的重要性。
德克萨斯大学西南医学中心分子生物学系和哈蒙再生科学与医学中心的研究者们,通过严格的谱系追踪发现,之前研究报道认为的星形胶质细胞转化为神经元(astrocyte-to-neuron,AtN)并非起源于常驻星形胶质细胞,而是来自AAV感染的内源性神经元。研究成果以“Revisiting astrocyte to neuron conversion with lineage tracing in vivo”为题,发表在Cell(IF:66.85)上。

研究结果
1. 通过AAV靶向脑星形胶质细胞
研究人员比较了几种常用AAV血清型在星形胶质细胞中的特异性表达能力。研究结果显示,注射后4天,大多数AAV病毒主要在GFAP阳性的星形胶质细胞中检测到基因表达。然而,到了注射后14天,AAV8和AAV9在星形胶质细胞中的表达显著下降,而在神经元中的表达增加。相比之下,AAV2和AAV5在星形胶质细胞中的特异性表达相对稳定。因此,在后续实验中,选择了AAV5作为较为理想的AAV血清型。

2. 通过NEUROD1进行高效的体内AtN转化?
研究人员通过注射不同病毒到小鼠皮层进行实验。结果显示,注射ND1-mCh病毒后,17天时79.8%的细胞为神经元,与对照组相比明显增加。然而,整体神经元和星形胶质细胞密度没有显著变化,此外,注射ND1-mCh病毒未观察到细胞表达未成熟神经元标志物。这表明ND1-mCh能有效标记神经元,但不会引起神经元密度的整体增加或未成熟神经元的出现。
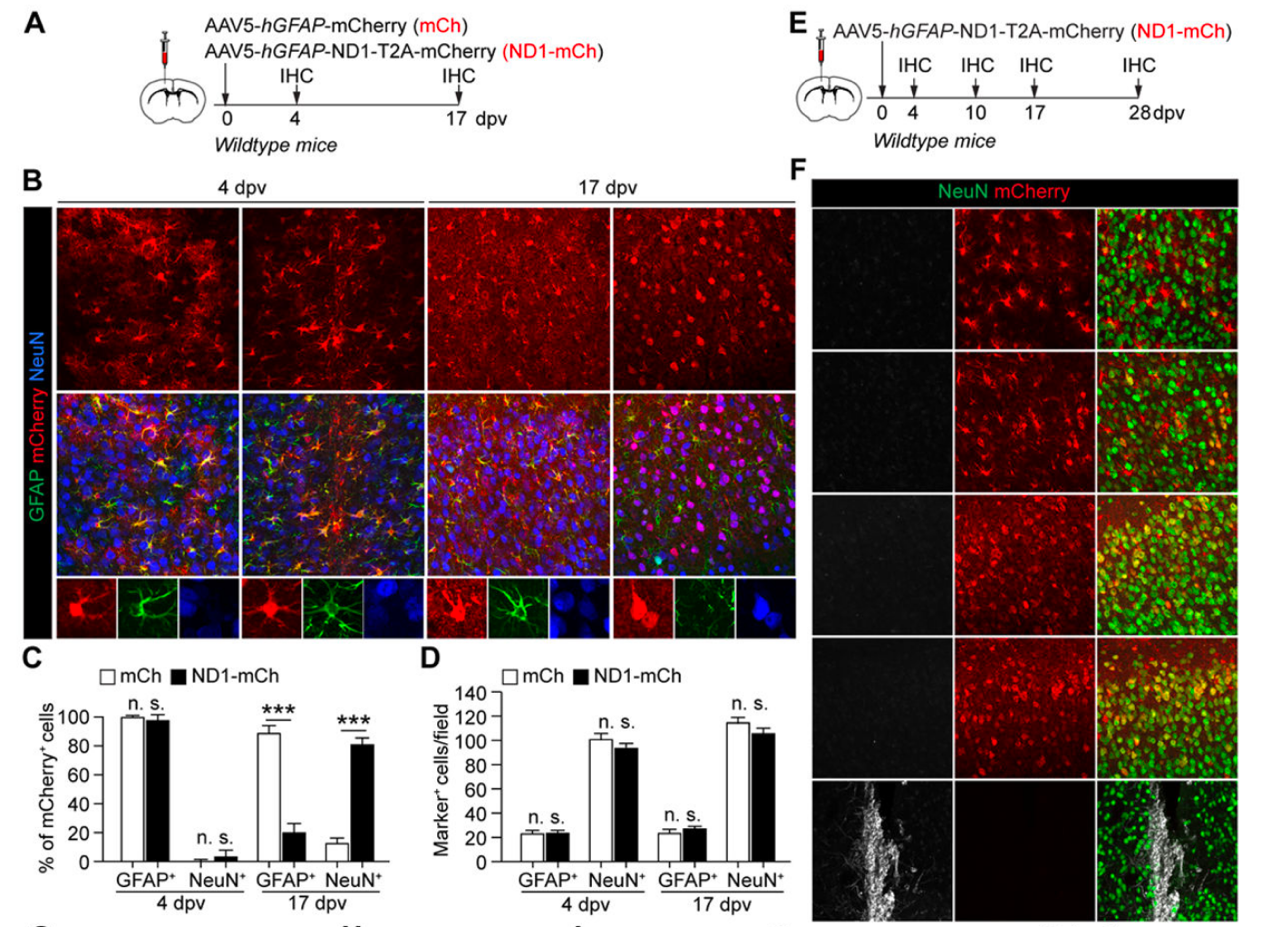
3. 反应性星形胶质细胞不是NEUROD1诱导的标记阳性神经元的起源。
体内重编程将反应性星形胶质细胞转化为神经元的治疗前景很有希望。通过在受伤的小鼠皮层进行实验,研究人员成功地将活性星形胶质细胞转化为神经元。然而,这种转化的效率很低,并未观察到显著增加周围神经元密度的现象。因此,反应性星形胶质细胞对NEUROD1诱导的神经元的形成没有起到重要作用。
4. 谱系示踪的星形胶质细胞不是NEUROD1诱导的标记阳性神经元的起源。
研究人员使用他莫昔芬诱导的小鼠模型追踪星形胶质细胞的命运。通过注射不同病毒,他们发现转化为神经元的细胞并非源自星形胶质细胞,而是可能来自其他细胞类型。这表明星形胶质细胞在体内重编程中的贡献有限。

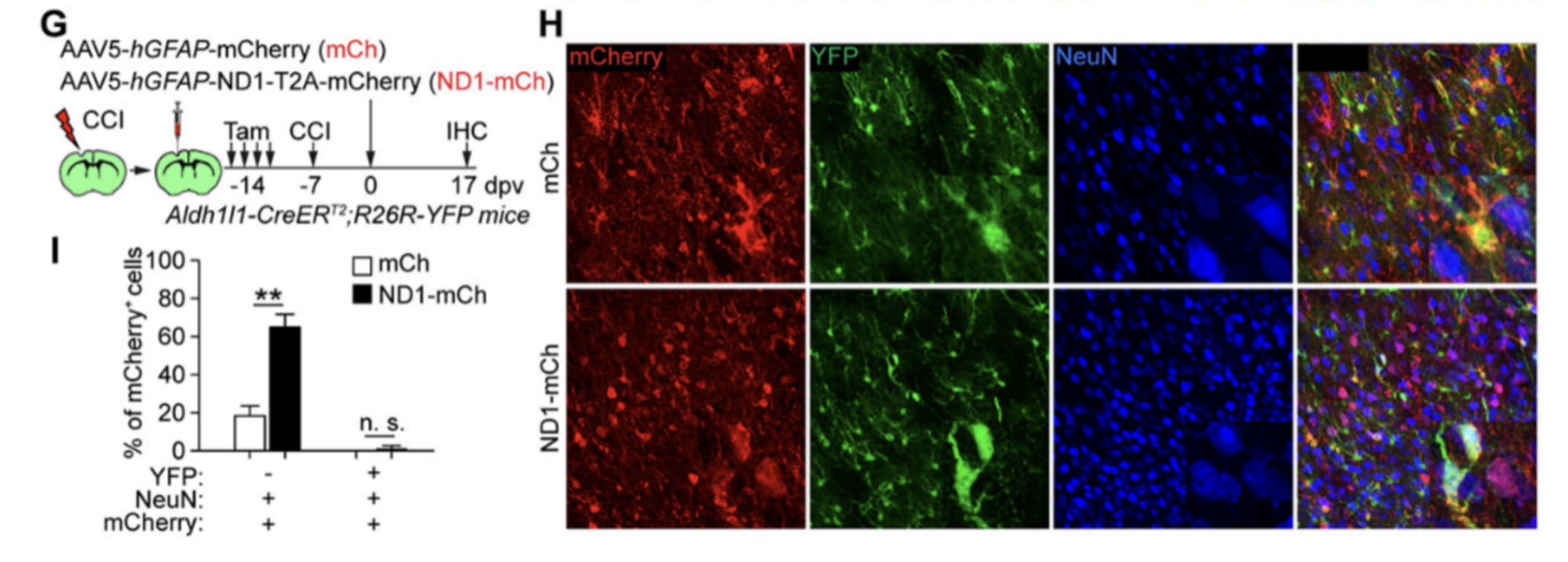
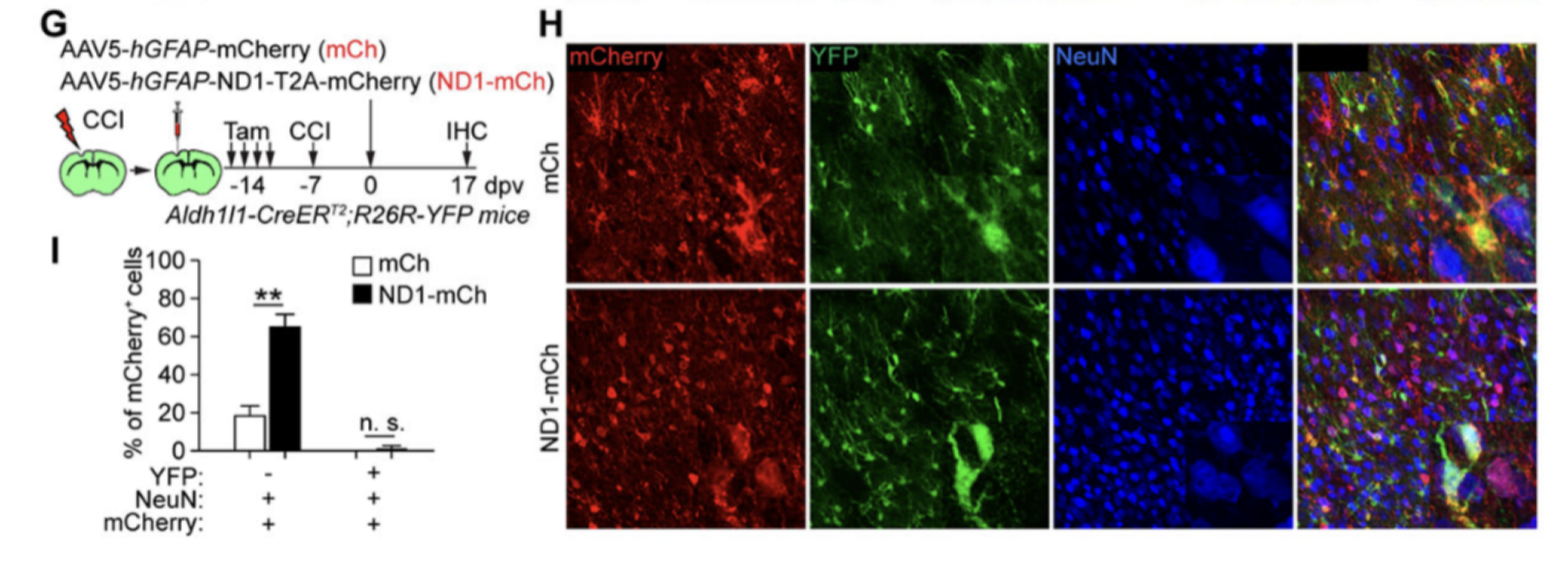
5. 脑损伤未能促使NEUROD1将被追踪的星形胶质细胞转化为神经元。
研究人员在经过他莫昔芬处理的小鼠中进行了脑损伤,并注射了mCherry或ND1-mCherry病毒。结果显示,ND1-mCherry病毒能够有效诱导mCherry+NeuN+细胞的产生,表明环境条件可能对星形胶质细胞的转分化起调控作用。然而,只有很少一部分细胞同时表达mCherry、NeuN和YFP,这可能是由于遗传标记背景的变异所致。
6. 基于AAV的Cre-FLEX系统未能限制星形胶质细胞中的基因表达。
研究人员使用基于AAV的Cre-FLEX系统进行Astrocyte-to-Neuron转换实验,但发现该系统在细胞类型特异性方面存在限制。虽然可以成功观察到转化后的神经元,但部分AAV血清型表达的Cre也在神经元中活跃,导致缺乏准确的细胞追踪。因此,该系统需要改进以实现更好的细胞类型特异性。
7. 限制于星形胶质细胞的NEUROD1无法引起AtN转换。
研究者使用了限制NEUROD1在星形胶质细胞中表达的策略,并注射了F-mCh或F-ND1-mCh AAV5病毒。结果表明,仅在成年星形胶质细胞中限制NEUROD1表达时,无法迅速诱导神经元形成。进一步的实验表明,即使在脑损伤后,仍无法通过星形胶质细胞特异性的NEUROD1诱导实现星形胶质细胞向神经元的转化。

8. 他莫昔芬和遗传背景都不会影响NEUROD1诱导报告基因阳性神经元的能力。
他莫昔芬处理对NEUROD1重编程能力的抑制不太可能发生,因为实验证据显示,无论是在他莫昔芬处理前注射病毒还是延迟处理方案中,NEUROD1仍然能够成功诱导mCherry+神经元的形成,而且没有受到YFP追踪的影响。因此,他莫昔芬处理不会阻断NEUROD1的重编程能力。
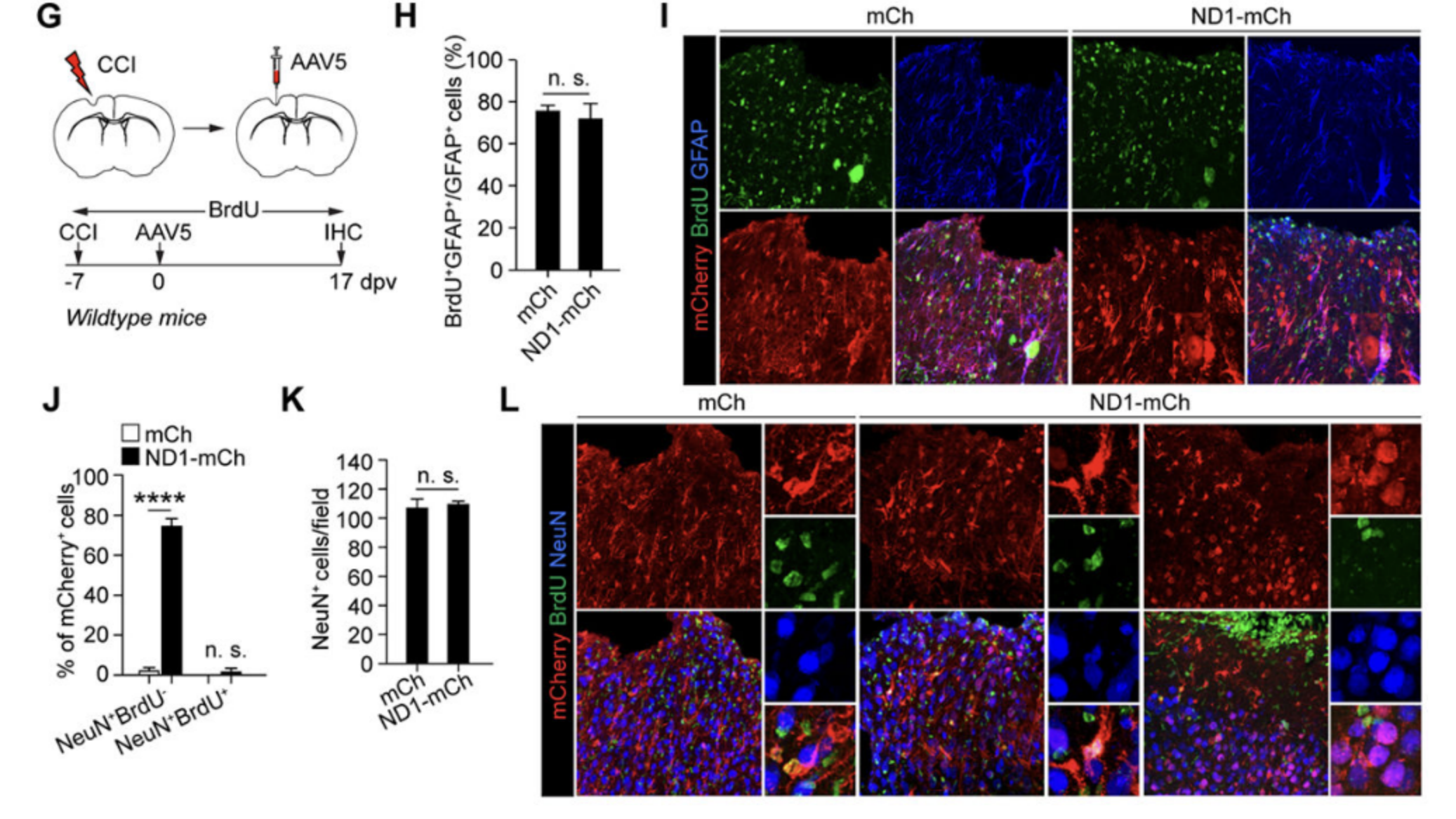
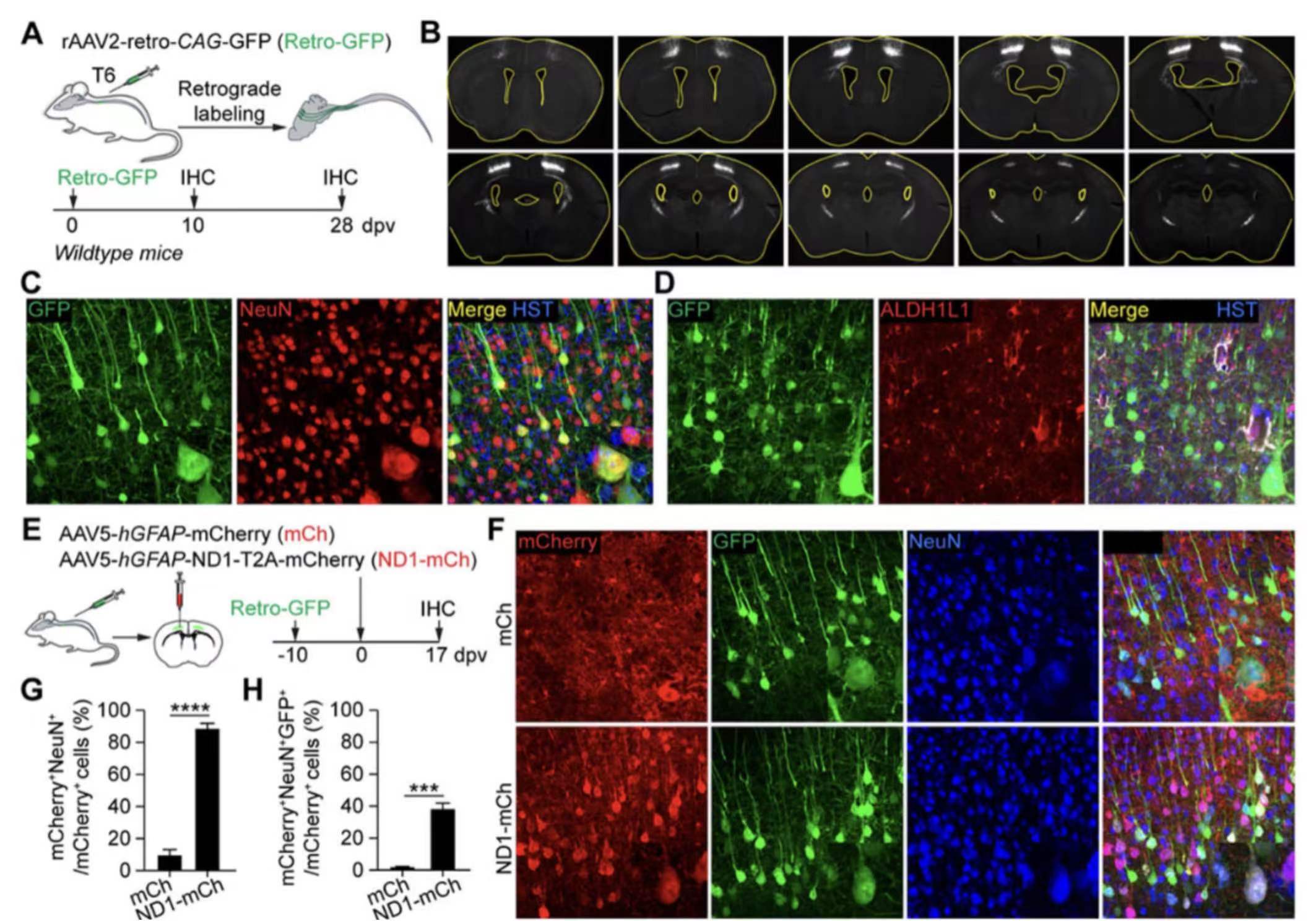
9. NEUROD1诱导的标记阳性神经元是内源性神经元。
遗传谱系追踪和BrdU标记结果表明,驻留的星形胶质细胞不是NEUROD1诱导的mCherry+神经元的来源。相反,通过逆行标记方法,研究人员发现内源性神经元是NEUROD1诱导的mCherry+神经元的来源。这些结果表明NEUROD1不能将星形胶质细胞直接转化为神经元,而是依赖于内源性神经元作为转化的来源。
10. 标记阳性神经元可以由选择性AAV表达因素诱导。
研究发现,使用hGFAP启动子下的AAV5病毒可以改变细胞类型特异性。通过检查多个因素的影响,发现PAX6、MYC、ASCL1和NEUROG2能够选择性地诱导mCherry+神经元,而SOX2、OCT4、KLF4和BDNF没有相同的效果。这表明hGFAP启动子下的AAV5病毒的细胞类型特异性可以被下游因素选择性地改变。

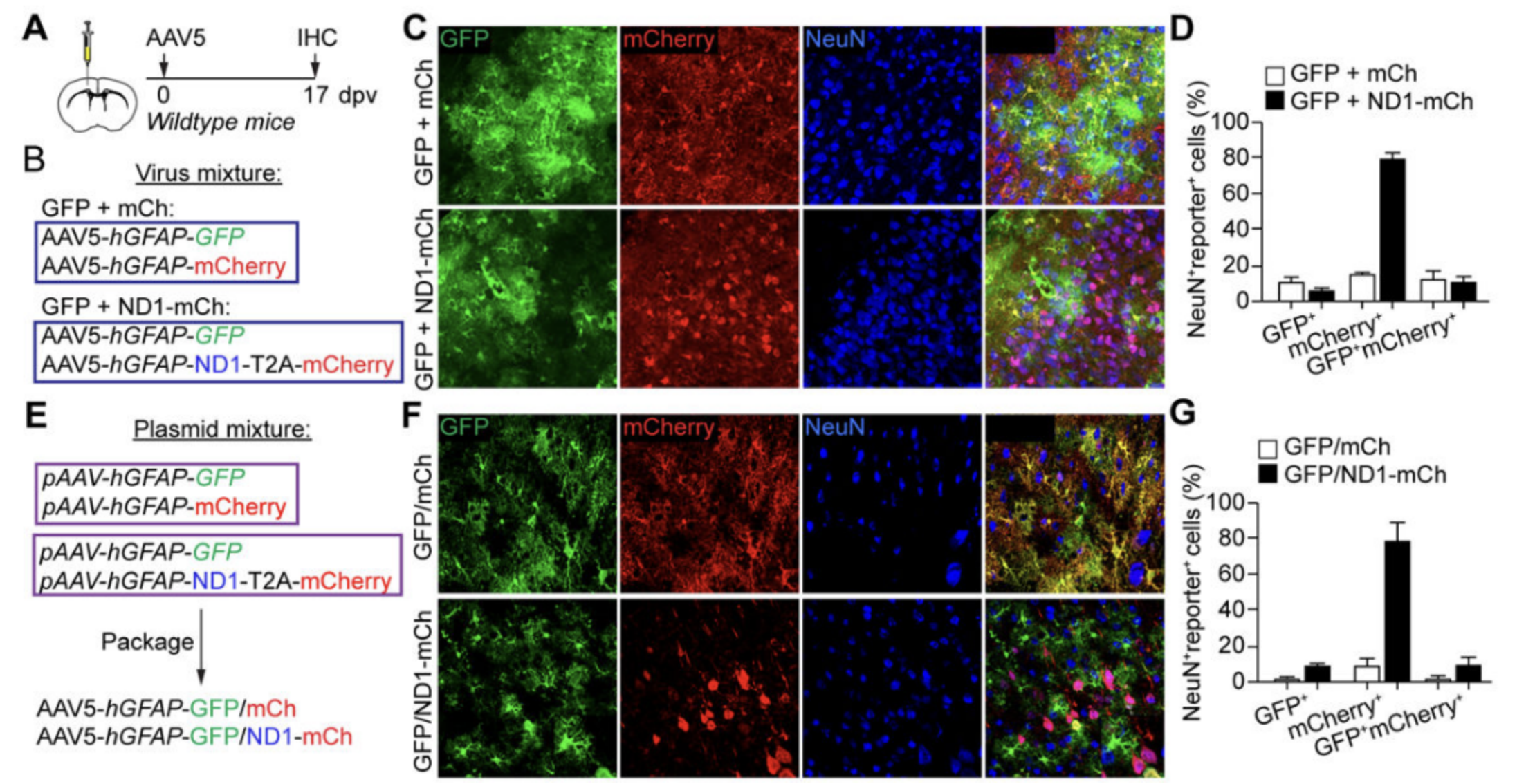
11. 启动子特异性可能由NEUROD1调节。
NEUROD1可能通过调节hGFAP启动子的特异性来诱导内源性神经元中的报告基因表达。共注射hGFAP-GFP AAV5病毒和mCh或ND1-mCh AAV5病毒的实验显示,在ND1-mCh组中观察到了许多特异性的mCherry+神经元,但很少观察到GFP+神经元。这暗示NEUROD1可能在内部调控hGFAP启动子的特异性。进一步的研究表明,与对照mCh AAV5病毒相比,共同包装的AAV-hGFAP-ND1-mCherry病毒在感染神经元方面更有效,这进一步支持了NEUROD1可能调节病毒包装过程中的特异性表达。这些结果表明NEUROD1可能以顺式调节的方式影响hGFAP启动子在内源性神经元中的表达特异性。
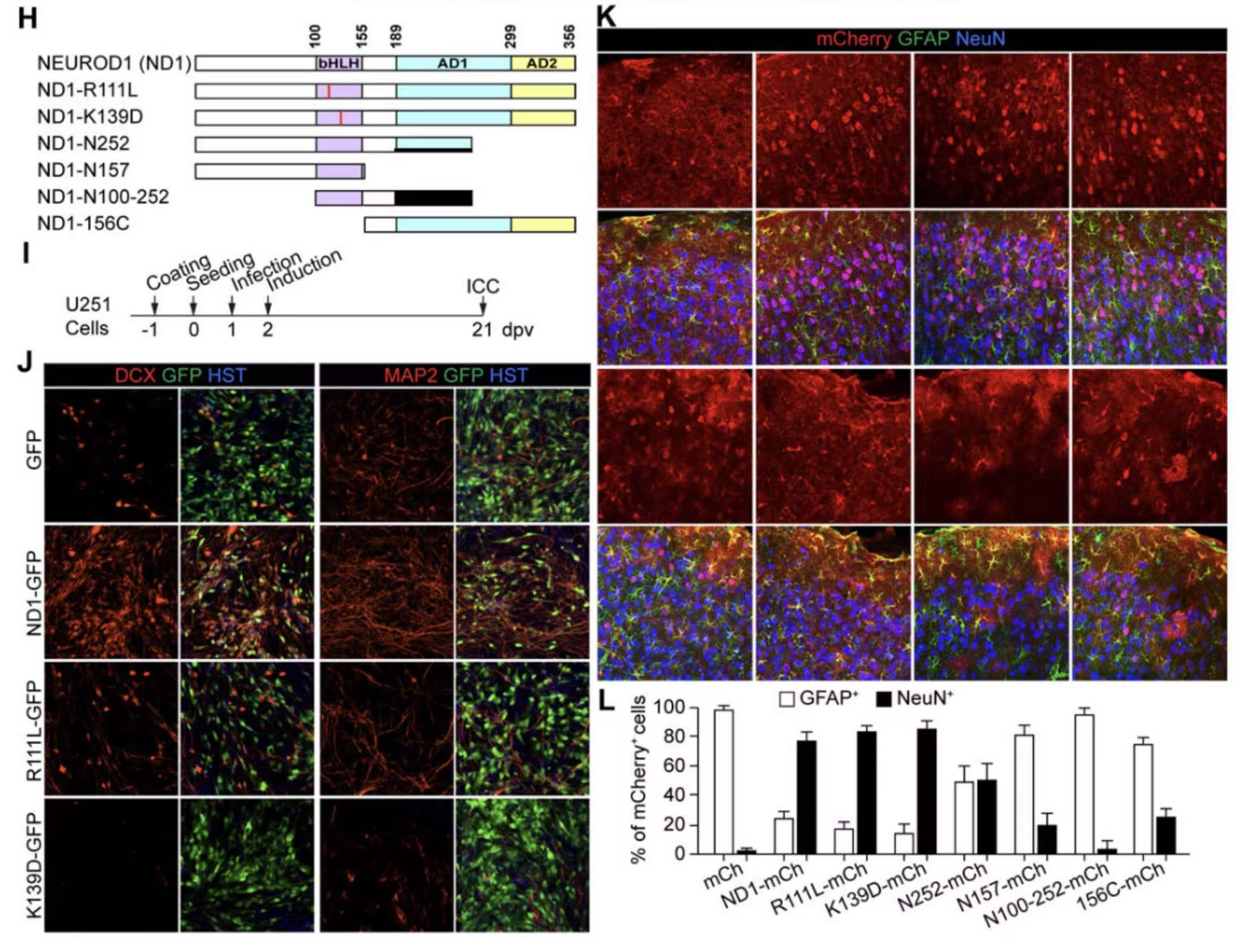
12. 诱导标记阳性神经元不需要NEUROD1的神经源性活动。
研究人员通过制作NEUROD1突变体来进一步研究其分子机制。实验结果表明,NEUROD1突变体失去了神经源性活性,但仍能有效诱导mCherry+神经元的产生。这表明NEUROD1诱导神经元的能力与其神经源性活性无关。
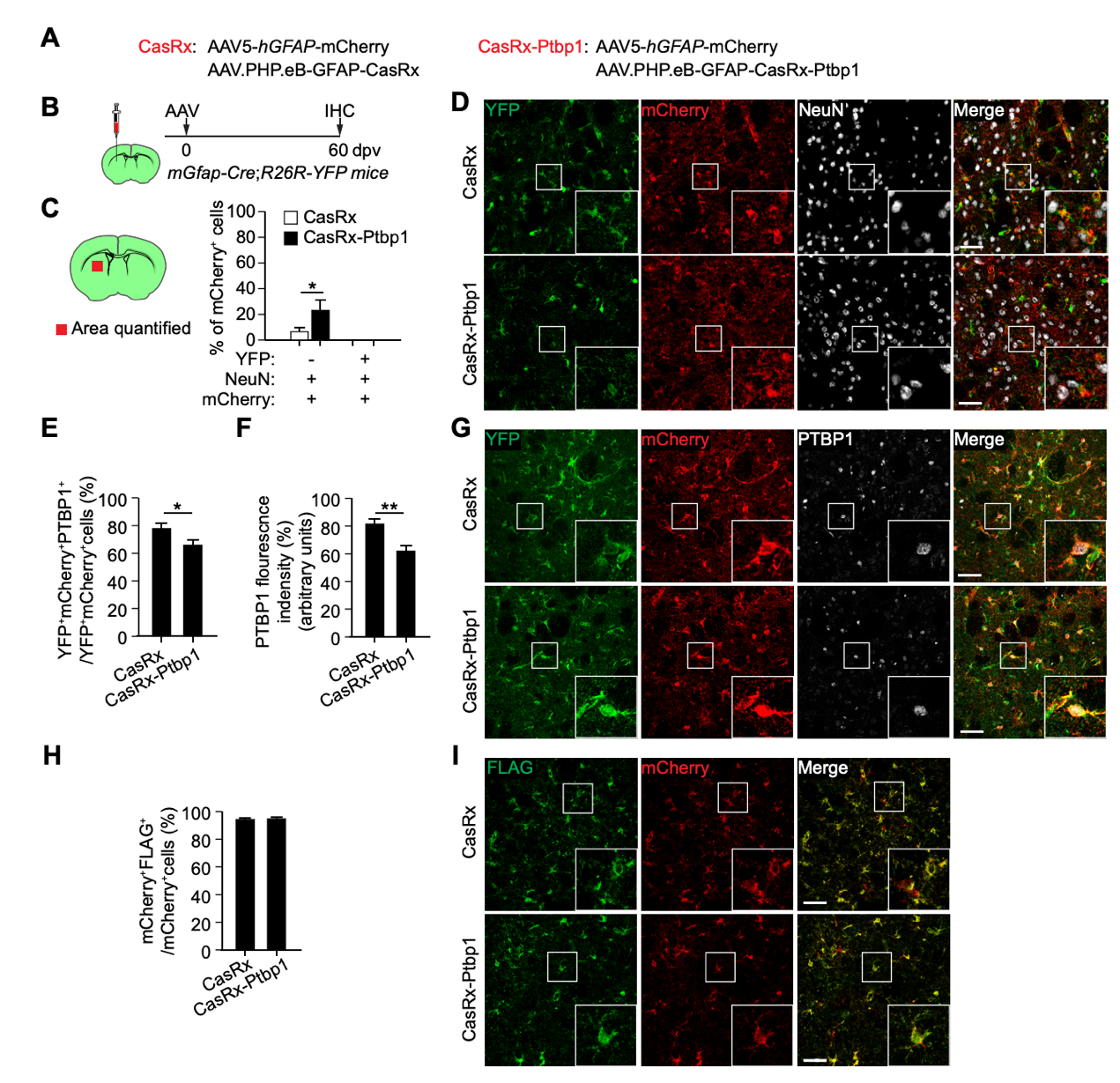
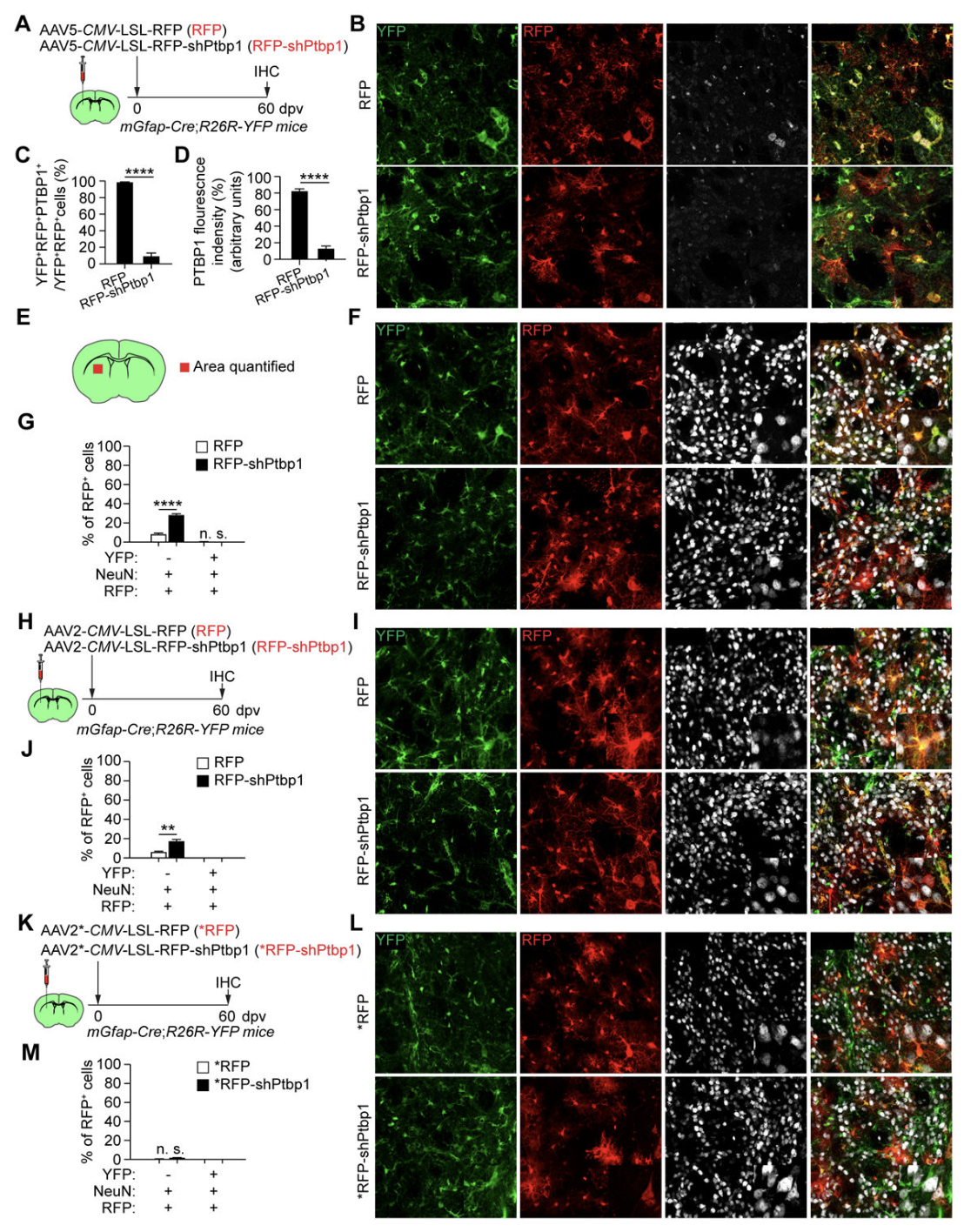
13. AAV-GFAP-CasRx-Ptbp1既不能有效地下调PTBP1,也不能在体内转换纹状体星形细胞。
研究人员调查了PTBP1对星形胶质细胞转化为神经元的作用。他们使用CRISPR-CasRx系统,将AAV-GFAP-CasRx-Ptbp1病毒注射到小鼠纹状体中,并进行了谱系追踪实验。结果显示,在CasRx-Ptbp1组中,只有22.7%的mCherry+细胞表达了神经元标记物NeuN,但没有被YFP标记,暗示它们不是星形细胞的后代。此外,通过免疫染色和免疫印迹验证,研究人员发现CasRx-Ptbp1病毒对PTBP1的表达仅有轻微下降。综上所述,AAV-GFAP-CasRx-Ptbp1病毒既未成功降低PTBP1的表达,也未能将纹状体星形胶质细胞转化为神经元,与之前的报道相矛盾。
14. PTBP1敲除未能在体内转换纹状体星形胶质细胞。
基于shRNA的方法进一步证实,沉默Ptbp1并不能将星形胶质细胞转化为神经元。无论是使用CRISPR-CasRx系统还是shRNA靶向Ptbp1,结果都显示仅有少数mCherry+细胞表达神经元标记物NeuN,而这些细胞并非星形胶质细胞的后代。因此,研究结果与之前的报道存在明显差异,表明Ptbp1的下调对于将星形胶质细胞转化为纹状体神经元并不有效。
进一步的实验使用了AAV-CMV-LSL-RFP和AAV-CMV-LSL-RFP-shPtbp1载体,将其注射到年轻的mGfap-Cre;R26R-YFP小鼠的纹状体中。研究结果表明,尽管成功敲除PTBP1,常驻纹状体星形胶质细胞无法在体内转化为神经元,无论是通过CRISPR-CasRx系统还是基于shRNA的方法。无论使用何种方法,都没有观察到常驻星形胶质细胞向神经元的转化,这与之前的报道形成了鲜明对比。

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
研究总结
这篇文章通过遗传谱系追踪和逆行标记的方法,重新审视了星形胶质细胞向神经元的转化过程。结果表明,星形胶质细胞并不是NEUROD1诱导的神经元的主要细胞来源。进一步实验证明,这些NEUROD1诱导的神经元实际上是来源于内源性神经元。研究还发现,NEUROD1可以选择性地改变hGFAP启动子的细胞特异性,但不能广泛上调该启动子的表达。此外,通过PTBP1基因的沉默实验也未观察到星形胶质细胞向神经元的转化。总体而言,这些结果揭示了星形胶质细胞向神经元的转化过程的细节,并为深入理解神经元发生和修复提供了重要线索。
