近期,Jin Ye 团队发表的文章 “Identification of hyperoxidized PRDX3 as a ferroptosis marker reveals ferroptotic damage in chronic liver diseases”[1],鉴定出首个铁死亡特异性标记物--Hyperoxidized PRDX3 (过氧化PRDX3)。该研究结果为铁死亡领域提供了一个期待已久的铁死亡标记物,从而能够更精确地检测这种独特的细胞死亡形式。
 缩略词
缩略词GPX4 : Glutathione peroxidase 4, 谷胱甘肽过氧化物酶 4
SLC7A11: Solute carrier family 7 member 11 , 溶质载体家族 7 成员 11
GSH: Cyst(e)ine-glutathione, 半胱氨酸-谷胱甘肽
GPX4: Glutathione peroxidase 4, 谷胱甘肽过氧化物酶 4
PRDX3: Peroxiredoxin 3, 过氧化过氧化还原蛋白 3
PRDXs: Peroxiredoxins, 过氧化还原蛋白
AFLD: Alcoholic fatty liver diseases, 酒精性脂肪肝
NAFLD: Nonalcoholic fatty liver diseases, 非酒精性脂肪肝
HFD: High fat diet, 高脂饮食

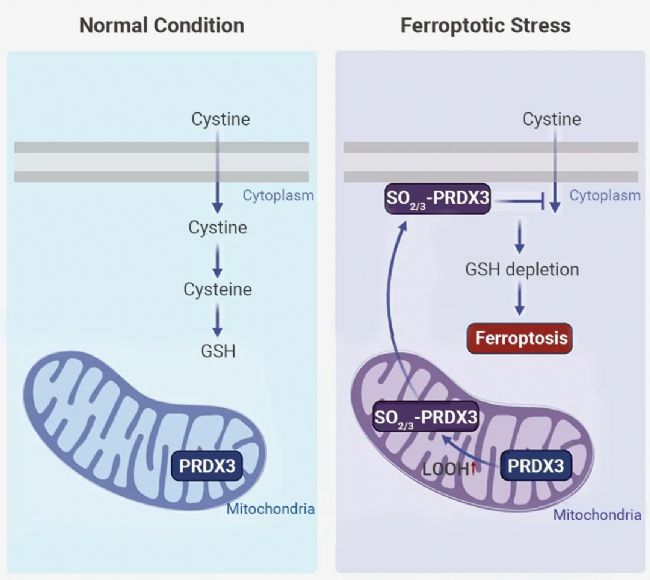
铁死亡是一种由脂质过氧化引起的调节性细胞死亡形式[2]。其主要防御机制是 SLC7A11-GSH-GPX4 轴[3]。在正常情况下 (图 1A),SLC7A11 介导胱氨酸摄取,并产生半胱氨酸 (Cys, Cysteine),促进了 GSH 的生物合成。GSH 是 GPX4 的辅助因子,可有效解毒脂质过氧化,抑制氧化应激损伤。

在正常情况下,典型的 2-Cys PRDXs,包括 PRDX1-4,可通过催化性 Cys 来还原过氧化物。反应产生的半胱磺酸 (Cys-SOH) 充当连接剂,利用二硫键连接过氧化 PRDXs 产生同二聚体。Cys-SOH 再被还原为 Cys,又可以重新参与到 PRDXs 的催化循环中 (反应 1-3)。
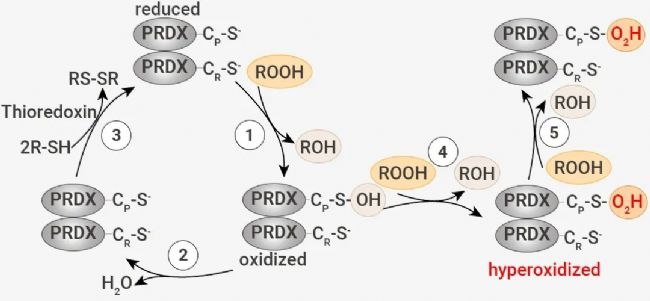 图 2. PRDXs 的过氧化催化循环[1]。
图 2. PRDXs 的过氧化催化循环[1]。
当过量的过氧化物积累时,二硫键形成的速率不够快,会导致 PRDXs 中的 Cys-SOH 被过氧化物进一步氧化,生成半胱亚磺酸 (Cys-SO2H)、磺酸 (Cys-SO3H),这是 PRDXs 的过氧化物 (反应 4-5)。因此,脂质过氧化物在铁细胞中的积累可能被 PRDXs 感知,导致蛋白质的过度氧化。
▐ PRDX3 在铁死亡细胞中被特异性过度氧化
作者使用可识别包含 PRDX1-4 的 Cys-SO2/3 H 的肽的抗体进行了免疫印迹分析。结果发现:(1) 在未经处理的 SV589 细胞中几乎检测不到任何信号; (2) 添加铁死亡诱导剂如 erastin、RSL3 或 FIN56 (图中仅显示 erastin) 处理的细胞中观察到~23 kDa 的单条带 (图 3B)。此外,该条带的检测可被抗体与过氧化抗原 (SO3-PRDX1-4 Peptide) 共孵育所阻断,但未被未修饰的对照肽阻断 (图 3B),表明该抗体特异性靶向过氧化 PRDX1-4。
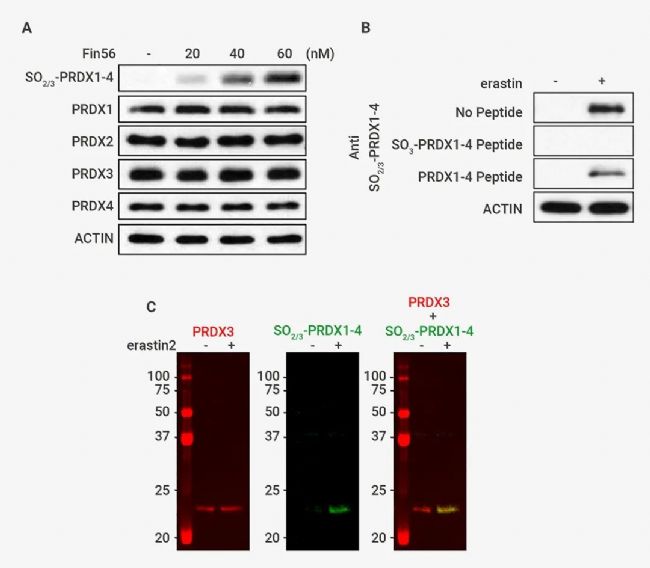
图 3. PRDX3 在铁死亡过程中被过度氧化[1]。
(A) 通过免疫印迹分析测定用指定浓度的 erastin、RSL3 或 FIN56 (此处未显示) 处理12 小时的 SV589 细胞中的过氧化量和总 PRDX1–4 量。(B) 加或不加 2µM erastin 处理 12 小时的细胞,在不存在 2 µg/mL 阻断性高氧化抗原肽或未修饰的对照肽的情况下进行免疫印迹分析。(C) 加或不加 200 nM erastin2 处理 12 小时的细胞裂解物在同一印迹中通过抗 PRDX3 和抗 SO2/3-PRDX1–4 进行免疫印迹,然后用分别红色和绿色荧光标记的二抗进行检测。
▐ 过氧化 PRDX3 通过抑制胱氨酸摄取诱导铁死亡
作者评估了过度氧化的 PRDX3 对其他化合物诱导的铁死亡的影响,结果表明,PRDX3-/- 能够更敏感地抑制直接作用于胱氨酸转运系统的铁死亡诱导剂( 例如 erastin 和 SAS),而对作用于下游 GPX4 水平的诱导剂(例如 RSL3 和 FIN56)敏感度降低。也就是说,过度氧化的 PRDX3 很有可能与 erastin 和 SAS 一样,通过抑制胱氨酸摄取来诱导铁死亡 (图 4A)。同时,利用荧光染色定位,研究人员发现本来存在于线粒体的 PRDX3 在过氧化修饰后转移到了细胞膜上(图 4C)。

图 4. 过氧化 PRDX3 可抑制胱氨酸摄取诱导铁死亡[1]。
随后,将细胞与 erastin 预孵育 9 小时 (9 h 后 WT 细胞中产生过氧化 PRDX3),检查过氧化的 PRDX3 对胱氨酸摄取的影响。结果表明,WT 细胞中的胱氨酸摄取受到抑制,但 PRDX3-/- 细胞中则不受抑制 (图中未显示),也就是说,过氧化的 PRDX3 可抑制胱氨酸摄取。
▐ 过氧化的 PRDX3 特异存在于铁死亡细胞中
为进一步评估过度氧化的 PRDX3 是否可以作为铁死亡的标志物。作者发现,在 SV589 细胞中,PRDXs 的过度氧化不因为发生细胞凋亡或者坏死性凋亡而产生 (图 5A, C),也不因为铜死亡诱导剂 Elesclomol 或 CCCP 的处理而产生,PRDX3 只在铁死亡中积累,具有特异性(图 5B,D)。
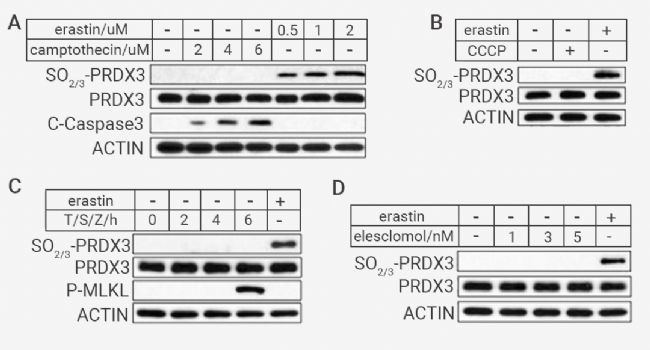
图 5. 不同细胞死亡类型中,只有铁死亡细胞中存在过氧化 PRDX3[1]。

小 M 还为大家整理了相关细胞死亡标志物汇总,有需求的小伙伴可以收藏备用喔~
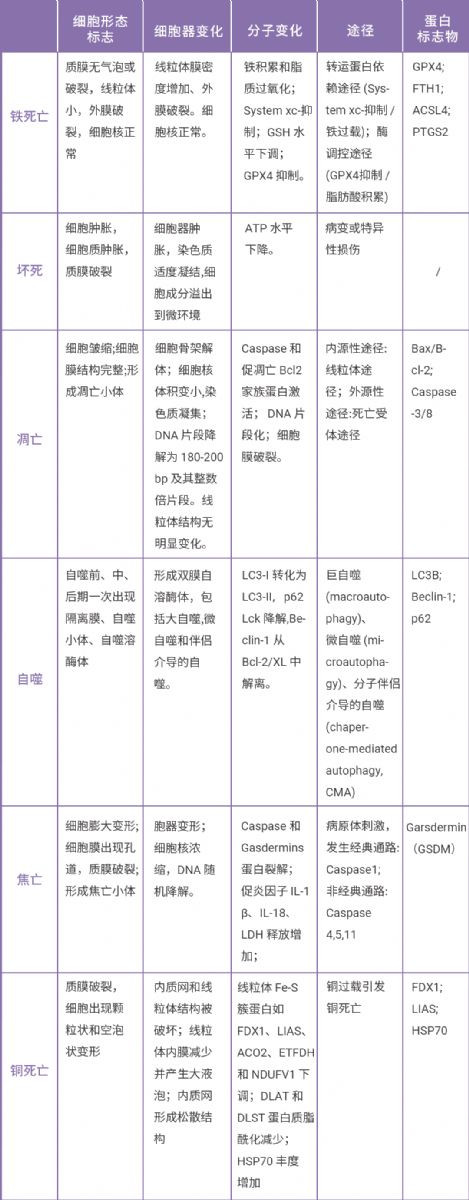

本文小 M 带大家一起认识了高分文献中验证 PRDX3 是铁死亡特异性标志物的思路和方法。过度氧化的 PRDX3 通过抑制胱氨酸输入促进铁死亡,决定了它独一无二的身份,为铁死亡研究领域填补了空白的一环。

|
铁死亡诱导剂,结合且抑制电压依赖性阴离子通道 (VDAC2/VDAC3)。 |
|
铁死亡诱导剂,可直接降低 GPX4 的表达。
|
|
铁死亡诱导剂,可导致 GPX4 降解来诱导铁死亡。 |
|
铁死亡诱导剂,还诱导细胞自噬和凋亡。
|
|
铁螯合剂,可结合 Fe(III) 和许多其他金属阳离子。 |
|
抗氧化剂和铁死亡抑制剂。 |
|
胱氨酸耗竭会诱导铁死亡。 |
|
用于测量线粒体膜电位的荧光探针试剂盒。
|
|
亲脂性红色荧光染料,可用于线粒体膜电位检测。 |
|
收集了 500+ 种文献报道的具有诱导或抑制铁死亡相关的化合物及与铁死亡密切相关的靶点对应的化合物,可以用于铁死亡机制及相关疾病的研究。 |
MCE的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献:
[1] Cui S, et al. Identification of hyperoxidized PRDX3 as a ferroptosis marker reveals ferroptotic damage in chronic liver diseases. Mol Cell. 2023 Nov 2;83(21):3931-3939.e5.
[2] Yan Y, Gan B. Hyperoxidized PRDX3 as a specific ferroptosis marker[J]. Life Metabolism, 2023: load042.
[3] Li J, et al. Ferroptosis: past, present and future. Cell Death Dis. 2020 Feb 3;11(2):88.
[4] Loveless R, Bloomquist R, Teng Y. Pyroptosis at the forefront of anticancer immunity. J Exp Clin Cancer Res. 2021 Aug 24;40(1):264.
[5] Frank D, et al. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019 Jan;26(1):99-114.
[6] Zhao G, et al. Copper induce zebrafish retinal developmental defects via triggering stresses and apoptosis. Cell Commun Signal. 2020 Mar 14;18(1):45.
[7] Wang L, et al. The emerging mechanisms and functions of microautophagy. Nat Rev Mol Cell Biol. 2023 Mar;24(3):186-203.
